Количественное ультразвуковое исследование (QUS) для оценки стеатоза печени при неалкогольной жировой болезни печени
Рубрика: Технологии, методики и стандарты
УЗ сканер Samsung HS60
Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Введение
Справочная информация
Неалкогольная жировая болезнь печени (НАЖБП) поражает примерно 25% населения по всему миру, при этом основной гистологической характеристикой НАЖБП является стеатоз печени [1]. НАЖБП может прогрессировать до неалкогольного стеатогепатита, при котором увеличивается риск развития фиброза, цирроза и гепатоцеллюлярной карциномы [2]. Поскольку своевременное выявление и лечение стеатоза может предотвратить прогрессирование заболевания или обратить его вспять, раннее обнаружение и точное определение стадии стеатоза печени крайне важно для пациентов с НАЖБП.
В настоящее время биопсия печени является «золотым стандартом» для диагностики НАЖБП, однако это инвазивный метод, который также подвержен ошибкам при отборе проб [3]. Магнитно-резонансная томография (МРТ) с определением фракции жира по протонной плотности (PDFF) является точным и воспроизводимым методом количественной оценки доли жира в печени. Этот метод использовался в качестве эталонного в нескольких клинических исследованиях [4, 5]. Вместе с тем он не очень распространен в обычной клинической практике из-за высокой стоимости и низкой доступности. В этом контексте методы ультразвуковой диагностики могут иметь хорошую перспективу благодаря своей неинвазивности, широкой доступности и экономической эффективности [6]. Вместе с тем у стандартного ультразвукового исследования есть ряд недостатков, например изначально качественный и субъективный характер и невысокая точность, особенно при умеренном стеатозе.
Количественное ультразвуковое исследование (QUS)
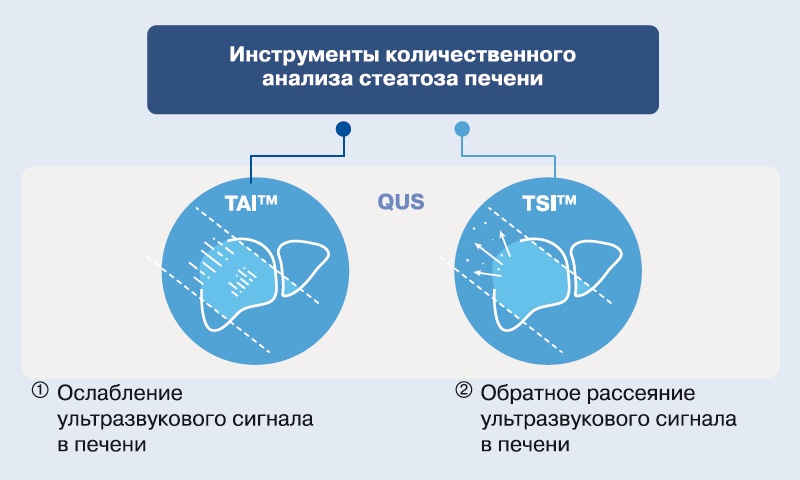
В последнее время для объективного выявления и классификации стеатоза печени стали использовать методы количественного ультразвукового исследования. Компания Samsung Medison разработала две технологии QUS - Tissue Attenuation Imaging (TAI™) и Tissue Scatter Distribution Imaging (TSI™), в которых для оценки степени выраженности стеатоза используются измерения ослабления или обратного рассеяния ультразвуковых сигналов.
Предыдущие клинические исследования с использованием прототипов этих технологий Samsung Medison продемонстрировали хорошие диагностические показатели для выявления стеатоза печени у пациентов с НАЖБП или хронической болезнью печени [7-9]. Однако в этих исследованиях оценивались только прототипы технологий, в которых измерения проводились с использованием автономного программного обеспечения, а эффективность инструментов QUS, встроенных в установленные ультразвуковые системы, была исследована не полностью.
- Основные принципы технологии TAI (Tissue Attenuation Imaging)
TAI - это функция, которая количественно измеряет ослабление ультразвуковых сигналов в печени. Ослабление ультразвукового сигнала выражается в потере его энергии при прохождении через ткани, оно зависит от свойств ткани и частоты сигнала. Ослабление сигнала в ткани печени увеличивается при ее жировой инфильтрации, которая может проявляться на обычных ультразвуковых изображениях как ухудшение визуализации диафрагмы или как снижение эхогенности в дальнем поле. Функция TAI измеряет ослабление на каждой глубине, сравнивая центральную частоту при приеме сигнала с центральной частотой передачи по всем глубинам. Поскольку высокочастотные компоненты сигнала ослабевают быстрее, по мере увеличения глубины центральная частота ультразвукового сигнала уменьшается. На рис. 1 показано, как ослабление сигнала приводит к изменению его центральной частоты с глубиной, при этом жировая инфильтрация печени связана с увеличением коэффициента ослабления ультразвукового сигнала.
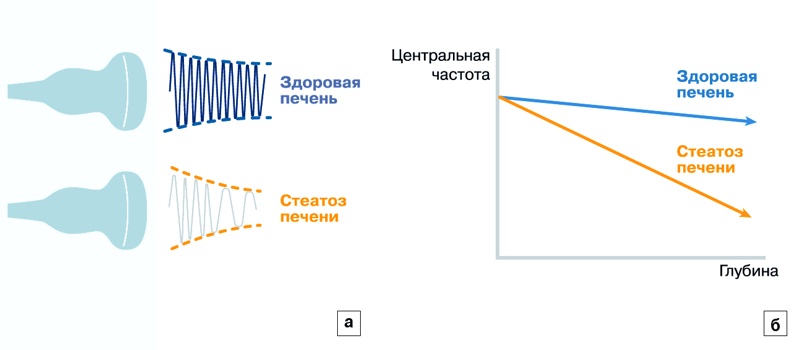
Рис. 1. а) ослабление ультразвукового сигнала в здоровой печени и при стеатозе; б) сдвиг центральной частоты в зависимости от глубины.
- Основные принципы технологии TSI (Tissue scatter distribution imaging)
TSI - это функция, которая количественно определяет распределение рассеянного сигнала. Рассеяние, то есть отражение ультразвуковых волн в нескольких направлениях, не зависящих от угла падения, приводит к появлению на ультразвуковых изображениях зернистого рисунка. Количество и распределение рассеивающих частиц в объеме разрешения влияют на статистическое распределение огибающей ультразвукового сигнала, поэтому количественные характеристики распределения рассеивающих частиц можно определить с помощью параметров статистической модели. Функция TSI определяет, является ли распределение большого числа рассеивающих частиц случайным - для этого используется модель распределения Накагами. Распределение Накагами хорошо описывает рассеяние в большинстве случаев как при небольшом, так и при значительном числе случайно распределенных рассеивателей - и даже при наличии дополнительных периодически расположенных рассеивателей. Основываясь на этой модели, функция TSI характеризует рассеяние путем количественной оценки корреляции между обратным рассеянием ультразвуковых сигналов и распределением Накагами (рис. 2).
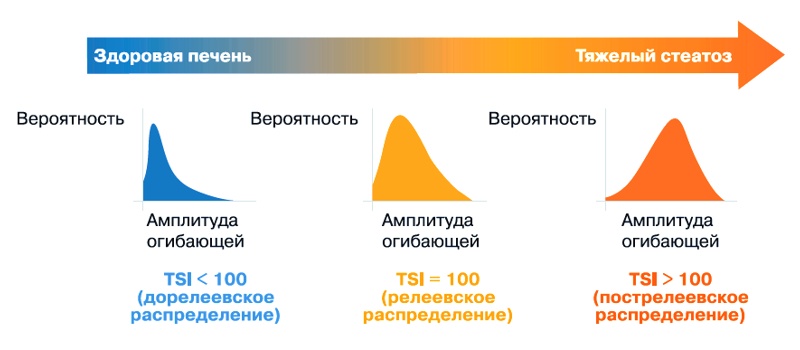
Рис. 2. Распределение рассеянных сигналов в зависимости от степени выраженности стеатоза печени.
Цель клинического исследования
Цель данного клинического исследования заключалась в проспективной оценке эффективности методов количественного ультразвукового исследования (QUS) для оценки стеатоза печени у пациентов с НАЖБП с использованием МРТ-PDFF в качестве эталонного метода сравнения.
Материал и методы
Выборка исследования
Данное проспективное исследование было одобрено Наблюдательным советом больницы Сеульского национального университета; информированное согласие было получено в письменной форме от всех участников. В период с июля 2020 г. по июнь 2021 г. было зарегистрировано в общей сложности 173 участника, среди которых были пациенты с подозрением на НАЖБП и пациенты, которые должны были пройти гепатэктомию для донорства фрагментов печени. Данные всех участников ранее были представлены в предыдущем исследовании [10], в котором оценивалась эффективность двухмерного алгоритма на основе сверточных нейронных сетей с использованием параметрических карт QUS и изображений в B-режиме для оценки стеатоза печени. Для каждого участника были выполнены исследования QUS (TAI и TSI) на ультразвуковой системе RS85 Prestige (Samsung Medison) с конвексным датчиком (CA1-7S), а также МРТ-PDFF. Для определения различных стадий стеатоза печени (стадия 1 [S1], 2 [S2] и 3 [S3]) использовались пороговые значения МРТ-PDFF: 5, 15 и 25% [11].
Измерение параметров QUS
Для измерения двух параметров QUS (TAI и TSI) на правую долю печени была помещена область интереса (ROI) размером 2 x 3 см на расстоянии не менее 2 см ниже глиссоновой капсулы, чтобы избежать артефактов реверберации. Положение области интереса выбиралось так, чтобы по возможности избежать попадания в нее крупных сосудов или очаговых поражений. Области со значительными погрешностями при расчете параметров, например области сосудистых структур, автоматически исключались из расчета и обозначались пустотами на картах TAI и TSI (рис. 3). Кроме того, достоверность измерений была представлена значением R2, и оператор старался получить результат со значением R2 ≥ 0,6. Каждый участник прошел два сеанса исследований в один и тот же день для оценки достоверности измерений параметров QUS. Во время каждого сеанса выполнялось пять измерений, результаты которых затем усреднялись для получения репрезентативного значения каждого параметра.
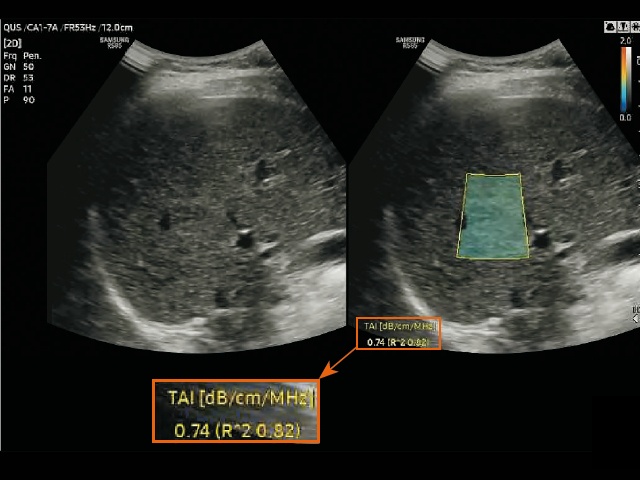
а) измерение в режиме визуализации ослабления в ткани (TAI) у пациентов без стеатоза печени.
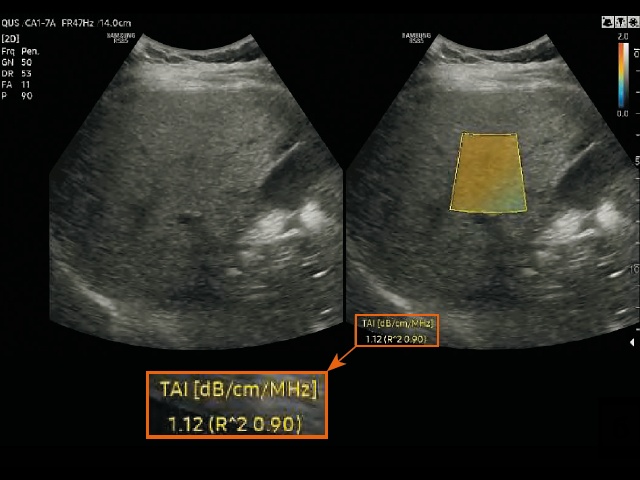
б) измерение в режиме визуализации ослабления в ткани (TAI) у пациентов со стеатозом печени.
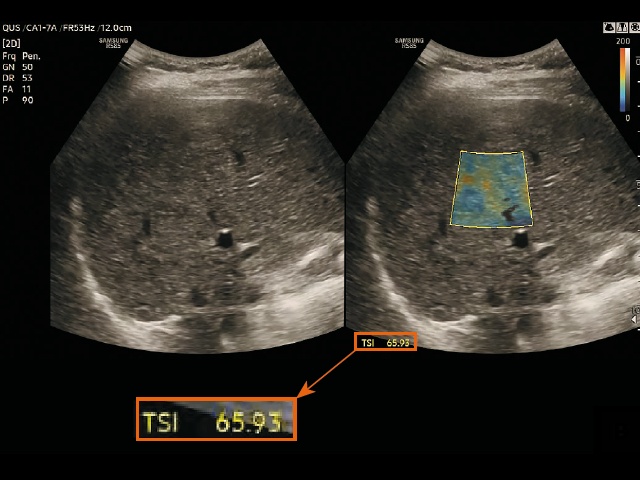
в) измерение в режиме визуализации распределения рассеяния в ткани (TSI) у пациентов со стеатозом печени.
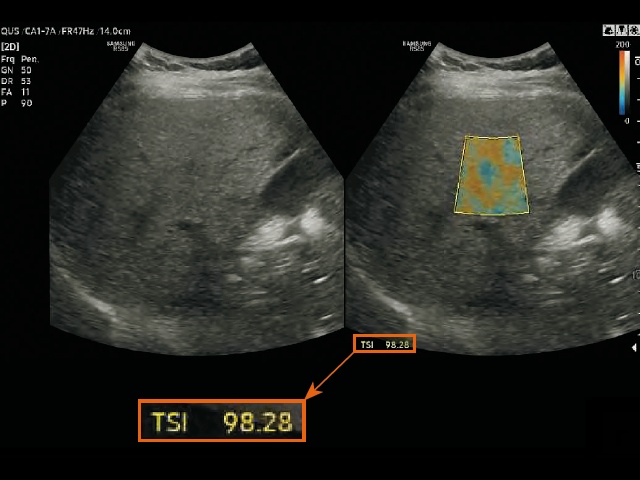
г) измерение в режиме визуализации распределения рассеяния в ткани (TSI) у пациентов со стеатозом печени.
Статистический анализ
Для оценки корреляции параметров QUS и МРТ-PDFF использовались коэффициенты корреляции Пирсона. Для оценки диагностической эффективности параметров QUS в определении различных стадий стеатоза печени (пороговые значения МРТ-PDFF 5, 15 и 25% для S1, S2 и S3 соответственно) использовался анализ кривой рабочей характеристики приемника (ROC). Для каждого анализа рассчитывались площадь под ROC-кривой (AUC), оптимальные значения порога отсечки и следующие параметры: чувствительность, специфичность, положительная прогностическая ценность и отрицательная прогностическая ценность. Оптимальное значение порога отсечки для каждого параметра QUS определялось с помощью индекса Юдена [12]. Кроме того, были получены значения порога отсечки TAI и TSI для уровней чувствительности и специфичности, превышающих 90%. Надежность результатов от исследования к исследованию оценивалась с использованием коэффициентов внутриклассовой корреляции (ICC), а результаты оценки интерпретировалась следующим образом: более 0,90 - отлично; 0,75-0,90 - хорошо; 0,50-0,75 - удовлетворительно; менее 0,50 - низкая надежность [13]. В качестве дополнительной характеристики надежности рассчитывался коэффициент вариации (CV) - отношение стандартного отклонения к среднему значению, при этом чем меньше было значение этого коэффициента, тем более надежным считалось измерение [14]. Все статистические расчеты проводились с использованием программы MedCalc версии 20.115 (MedCalc Software). Статистически значимыми считались результаты со значением p < 0,05.
Программа исследования
- После проверки датчика и области применения начните сканирование.
- Выберите [QUS] на сенсорном экране, затем активируйте функцию [TAI] или [TSI].
- Просканируйте правую долю печени через межреберное пространство.
- После получения нужного изображения нажмите кнопку [Freeze] (Стоп-кадр).
- С помощью трекбола переместите рамку области интереса в нужное положение для измерений.
- Поместите рамку области интереса на паренхиму печени, избегая при этом крупных сосудов.
- Область интереса должна располагаться не менее чем на 1,5 см ниже капсулы печени.
- Нажмите кнопку [Set] (Установить) на панели управления для подтверждения результатов.
Рекомендации по сканированию
- Получение ультразвуковых изображений печени
- Пациент должен голодать в течение не менее 4 ч до начала процедуры.
- Во время сканирования пациент должен располагаться в положении лежа на спине или с небольшим поворотом на левый бок (не более 30°), правая рука над головой.
- Для измерений сканирование следует проводить через межреберное пространство.
- Датчик должен располагаться перпендикулярно капсуле печени.
- Положение области интереса
- Более 1,5 см ниже поверхности капсулы печени (рекомендуется более 2 см).
- Следует избегать областей с крупными сосудами.
- Область интереса должна располагаться в максимально однородной зоне.
- Следует избегать слишком глубокой части (>8 см).
- Следует располагать рядом с центральной линией, в противном случае результаты могут быть ненадежными.
- Следует исключить движение во время измерений.
- Измерения следует выполнять в области со значением R2, равным 0,6 или более.
Результаты
Характеристики участников
В общей сложности в анализ было включено 173 участника (96 мужчин и 77 женщин, средний возраст 51,1 ± 14,1 года). Среднее значение МРТ-PDFF составляло 11,2 ± 7,8% (диапазон 1,5-46,4%). На основании значений МРТ-PDFF стеатоз стадии S0, S1, S2 и S3 был классифицирован у 47, 79, 37 и 10 пациентов соответственно. Число пациентов со стеатозом ≥S1, ≥S2 и S3 составило 126 (72,8%), 47 (21,2%) и 10 (5,8%) соответственно. Характеристики участников исследования приведены в табл. 1.
| Характеристика | Значение |
|---|---|
| Возраст, годы | 51,1 ± 14,1 (19-74) |
| Пол: | |
| мужчины | 96 (55,5) |
| женщины | 77 (44,5) |
| Индекс массы тела, кг/м2 | 26,5 ± 3,5 (19,2-39,8) |
| Расстояние между кожей и капсулой печени, мм | 20,7 ± 4,3 |
| МРТ-PDFF, % | 11,2 ± 7,8 (1,5-46,4) |
| < 5% (S0) | 47 (27,2) |
| От ≥5% до <15% (S1) | 79 (45,7) |
| От ≥15% до <25% (S2) | 37 (21,4) |
| ≥ 25% (S3) | 10 (5,8) |
Данные представлены в виде среднего значения ± стандартное отклонение (диапазон) или числовой величины (%) в зависимости от показателя.
Диагностическая эффективность параметров QUS при оценке стеатоза печени
Данные о диагностической эффективности параметров QUS для оценки стеатоза печени на основе МРТ-PDFF приведены в табл. 2 и на рис. 4. Площадь под ROC-кривой для измерений TAI и TSI при выявлении стеатоза печени (≥S1) составляла соответственно 0,917 и 0,905 (95% ДИ 0,865-0,953 и 0,851-0,944, p < 0,001). При выявлении стеатоза печени значения TAI > 0,72 дБ/см/МГц обладали чувствительностью 82,5% и специфичностью 91,5%, а значения TSI > 95,6 имели чувствительность 83,3% и специфичность 80,9%.
Площадь под ROC-кривой для измерений TAI и TSI при выявлении умеренного или тяжелого стеатоза печени (≥S2) составляла соответственно 0,914 и 0,843 (95% ДИ 0,862-0,951 и 0,780-0,894, p < 0,001). При выявлении среднетяжелого или тяжелого стеатоза печени значения TAI > 0,83 дБ/см/МГц имели чувствительность 78,7% и специфичность 91,3%, а значения TSI > 98,4 - чувствительность 93,6% и специфичность 64,3%. Площадь под ROC-кривой для измерений TAI и TSI при выявлении тяжелого стеатоза печени (S3) равнялась соответственно 0,898 и 0,813 (95% ДИ 0,843-0,939 и 0,747-0,868, p < 0,001). При выявлении тяжелого стеатоза печени значения TAI > 0,86 дБ/см/МГц имели чувствительность 100% и специфичность 79,8%, а значения TSI > 98,9 - чувствительность 100% и специфичность 54,0% (табл. 2, рис. 4).
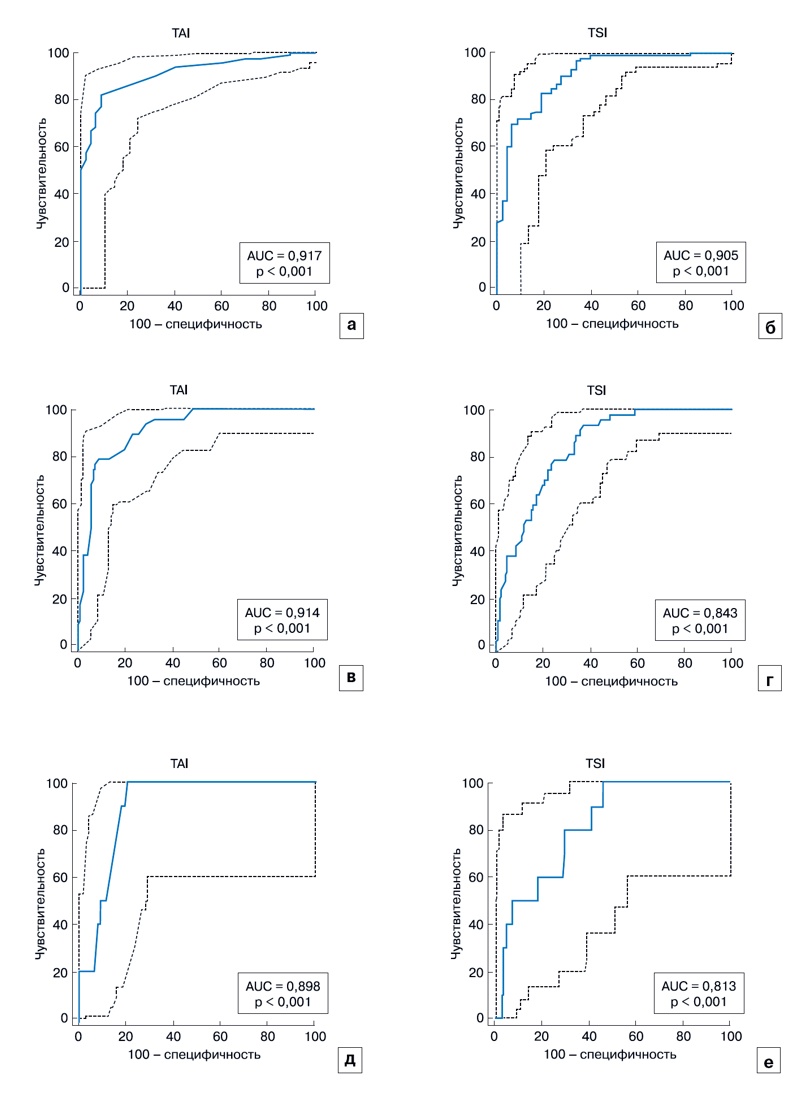
Рис. 4. Диагностическая эффективность TAI (a, в, д) и TSI (б, г, е) для выявления стеатоза печени (≥ S1 (a, б), ≥ S2 (в, г) и S3 (д, е).
| Показатель | TAI | TSI | ||||||
|---|---|---|---|---|---|---|---|---|
| AUC (95% ДИ) |
порог отсечки |
чувствите- льность, % |
специфич- ность, % |
AUC (95% ДИ) |
порог отсечки |
чувствите- льность, % |
специфич- ность, % |
|
| МРТ-PDFF ≥5% (≥S1) | 0,917 (0,865-0,953) | 0,905 (0,851-0,944) | ||||||
| Оптимальный порог отсечки | >0,72 | 82,5 | 91,5 | >95,6 | 83,3 | 80,9 | ||
| Чувствительность 90% | >0,69 | 90,5 | 68,1 | >93,4 | 90,5 | 72,3 | ||
| Специфичность 90% | >0,72 | 82,5 | 91,5 | >98,1 | 71,4 | 91,5 | ||
| МРТ-PDFF ≥15% (≥S2) | 0,914 (0,862-0,951) | 0,843 (0,780-0,894) | ||||||
| Оптимальный порог отсечки | >0,83 | 78,7 | 91,3 | >98,4 | 93,6 | 64,3 | ||
| Чувствительность 90% | >0,77 | 93,6 | 71,4 | >98,4 | 93,6 | 64,3 | ||
| Специфичность 90% | >0,83 | 78,7 | 91,3 | >103,8 | 42,6 | 91,3 | ||
| МРТ-PDFF ≥25% (≥S3) | 0,898 (0,843-0,939) | 0,813 (0,747-0,868) | ||||||
| Оптимальный порог отсечки | >0,86 | 100 | 79,8 | >98,9 | 100 | 54,0 | ||
| Чувствительность 90% | >0,88 | 90,0 | 81,6 | >100,0 | 90,0 | 58,9 | ||
| Специфичность 90% | >0,93 | 50,0 | 90,8 | >105,5 | 50,0 | 92,6 | ||
Корреляция между параметрами QUS и МРТ-PDFF
Значения TAI и TSI имеют сильную положительную корреляцию с МРТ-PDFF (r = 0,776 и 0,635; 95% доверительный интервал (ДИ) = 0,708-0,829 и 0,537-0,716, p < 0,001). Распределение значений TAI и TSI в соответствии с МРТ-PDFF представлено на рис. 5.
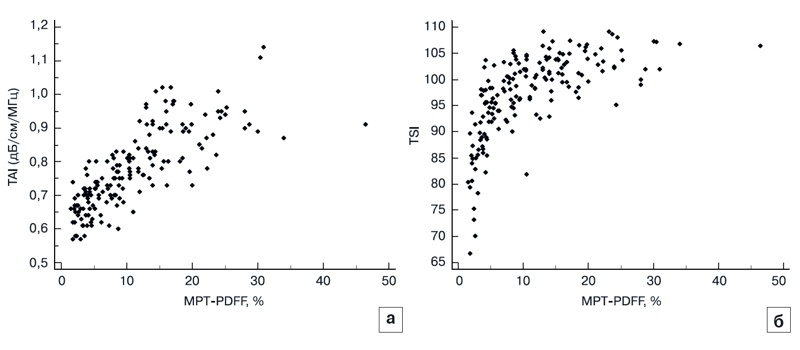
Рис. 5. Распределение значений TAI (a) и TSI (б) в соответствии с фракцией жира, определенной методом МРТ со взвешиванием по протонной плотности (MRI-PDFF).
Воспроизводимость TAI и TSI
Воспроизводимость значений TAI и TSI между исследованиями была высокой с коэффициентом внутриклассовой корреляции ICC 0,975 (95% ДИ 0,966-0,982) и 0,924 (0,898-0,944) соответственно. Значения коэффициента вариации для TAI и TSI составили 3,3% (95% ДИ 2,9-3,7) и 3,2% (95% ДИ 2,8-3,6) соответственно.
Заключение
Методы количественного ультразвукового исследования (TAI и TSI) показали хорошие результаты в выявлении и оценке стадии стеатоза печени. Таким образом, эти методы являются полезным инструментом для оценки выраженности стеатоза печени у пациентов с НАЖБП.
Поддерживаемые системы: RS85, V8, V7, V6
Литература
- Castera L., Friedrich-Rust M., Loomba R. Noninvasive assessment of liver disease in patients with nonalcoholic fatty liver disease // Gastroenterology. 2019; 156: 1264-1281.e4.
- Vernon G., Baranova A., Younossi Z.M. Systematic review: the epidemiology and natural history of nonalcoholic fatty liver disease and non-alcoholic steatohepatitis in adults // Aliment Pharmacol Ther. 2011; 34: 274-285.
- Machado M.V., Cortez-Pinto H. Non-invasive diagnosis of nonalcoholic fatty liver disease. A critical appraisal // J Hepatol. 2013; 58: 1007-1019.
- Reeder S.B., Cruite I., Hamilton G., Sirlin C.B. Quantitative assessment of liver fat with magnetic resonance imaging and spectroscopy // J Magn Reson Imaging. 2011; 34: 729-749.
- Tang A., Desai A., Hamilton G. et al. Accuracy of MR imagingestimated proton density fat fraction for classification of dichotomized histologic steatosis grades in nonalcoholic fatty liver disease // Radiology. 2015; 274: 416-425.
- Yokoo T., Serai S.D., Pirasteh A. et al. Linearity, bias, and precision of hepatic proton density fat fraction measurements by using MR imaging: a meta-analysis // Radiology. 2018; 286: 486-498.
- Jeon S.K., Joo I., Kim S.Y. et al. Quantitative ultrasound radiofrequency data analysis for the assessment of hepatic steatosis using the controlled attenuation parameter as a reference standard // Ultrasonography. 2021; 40: 136-146.
- Jeon S.K., Lee J.M., Joo I. Clinical Feasibility of Quantitative Ultrasound Imaging for Suspected Hepatic Steatosis: Intra- and Inter-examiner Reliability and Correlation with Controlled Attenuation Parameter // Ultrasound Med Biol. 2021; 47 (3): 438-445.
- Jeon S.K., Lee J.M., Joo I., Park S.J. Quantitative Ultrasound Radiofrequency Data Analysis for the Assessment of Hepatic Steatosis in Nonalcoholic Fatty Liver Disease Using Magnetic Resonance Imaging Proton Density Fat Fraction as the Reference Standard // Korean J Radiol. 2021; 22 (7): 1077-1086.
- Jeon S.K., Lee J.M., Joo I. et al. Two-dimensional Convolutional Neural Network Using Quantitative US for Noninvasive Assessment of Hepatic Steatosis in NAFLD // Radiology. 2023; 307 (1): e221510. DOI: 10.1148/radiol.221510.
- Starekova J., Hernando D., Pickhardt P.J., Reeder S.B. Quantification of Liver Fat Content with CT and MRI: State of the Art // Radiology. 2021; 301 (2): 250-262.
- Youden W.J. Index for rating diagnostic tests // Cancer. 1950; 3: 32-35.
- Koo T.K., Li M.Y. A guideline of selecting and reporting intraclass correlation coefficients for reliability research // J Chiropr Med. 2016; 15: 155-163.
- Bland J.M., Altman D.G. Statistical methods for assessing agreement between two methods of clinical measurement // Lancet. 1986; 1: 307-310.

УЗ сканер Samsung HS60
Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Публикации по теме
- HeartAssist™ – инструмент автоматической классификации проекций и выполнения измерений при трансторакальной эхокардиографии взрослых - Hyuk-Jae Chang
- MV-Flow™ в оценке объемных образований в почках - Vinay A. Duddalwar
- Количественное ультразвуковое исследование (QUS) для оценки стеатоза печени при неалкогольной жировой болезни печени - Sun Kyung Jeon
- Настройка ультразвуковых приборов в режиме цветового допплеровского картирования и сепии - Цоколов А.В.
- Проспективная оценка степени фиброза печени с помощью технологии S-Shearwave Imaging™. Сравнение с магнитно-резонансной эластографией - Jeong Eun Lee

