Эволюция диагностики аномальной плацентации (placenta accreta spectrum)
2 Медицинский центр «Умная клиника», Ростов-на-Дону
3 Медицинский центр «Надежда», Ставрополь
Рубрика: Эхография в акушерстве

УЗИ аппарат HM70A
Экспертный класс по доступной цене. Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.
Врастание (приращение) плаценты (ВП) - патологическое состояние, патоморфология которого заключается в полном или частичном отсутствии децидуальной оболочки (decidua basalis), приводящем к аномальному прикреплению (приращению/прорастанию) ворсин плаценты к миометрию [1].
С данным состоянием врачи сталкивались многие десятилетия и даже столетия тому назад, не совсем представляя его патогенетической сути. Так, в 1909 г. М.А. Скульский описал клинический случай двухмесячной задержки плаценты после родов. Автор писал: «... как извѣстно, наиболѣе частыми причинами задержки плаценты являются ненормальности со стороны соединения матки с плацентой, как напримѣр: непомѣрное разрастание chorion'a за пределы decidua serotina в стѣнку самой матки, т.е. въ ея мускулатуру и кровеносные сосуды...» [2]. Автор констатировал факт летального исхода у пациентки на фоне септицемии при обызвествлении с переходом на матку неотделяемой плаценты, «... вероятно плацента была тѣснѣйшимъ образом срощена со стѣнкой матки и составляла с ней как бы единое целое и поэтому не отдѣлилась».
Спустя 28 лет акушер C. Irving и патолог A.T. Hertig предложили термин «врастание плаценты», впервые определив его как «аномальное прилегание последа полностью или частично к подлежащей стенке матки». Авторы опубликовали статью, в которой представили обзор литературы (86 случаев) и свои данные с описанием клинической картины и гистопатологии 20 случаев приращения плаценты (placenta accreta) [3]. Однако приоритетная «пальма первенства» в описании данной аномалии плацентации все-таки принадлежит канадскому специалисту D.S. Forster (Монреаль, Канада), который в 1927 г. первым опубликовал в PubMed случай диагностики placenta accreta, представив гистологическое описание инвазии ворсин плаценты в миометрий [4]. А еще в 1885 г. K.N. McDonald использовал термин «morbidly adherent placenta» («патологически прикрепленная плацента») в статье, посвященной профилактике сепсиса при задержке плаценты в матке после родов [5]. В 1966 г. R.K. Luke и соавт. отчасти продублировали формулировку K.N. McDonald, предложив научному обществу термин «abnormally adherent or invasive placenta» [6].
Прошедшие десятилетия отмечены значительной эволюцией не только в частоте встречаемости данной патологии плацентации, но и в диагностических подходах и алгоритмах ведения таких пациенток.
«Истинное приращение плаценты - явление очень редкое», - мнение корифея отечественного акушерства М.С. Малиновского, высказанное им в 1955 г. на страницах классического издания «Оперативное акушерство» [7]. «Еще в 1741 году опытная акушерка Юстина Зигемундин писала, что может пройти много лет, прежде чем удастся увидеть действительно приросшую плаценту», - подтверждал свое мнение автор руководства [7].
По данным J.L. Breen и соавт., «приращенные» плаценты крайне редки и встречаются в одном случае из 7000 родов [8]. В течение 20-летнего периода J.E. Morison исследовал 67 маток, удаленных из-за приращения плаценты при 645 000 родов в Северной Ирландии [9].
С середины XX века по настоящее время частота аномального прикрепления (врастания) плаценты возросла в десятки раз: с 1 : 25 000-50 000 родов до 1 : 500-1000 в настоящее время, а в специализированных центрах - до 1 : 343 [10]. Такая динамика процесса объясняется прогрессивным ростом частоты оперативных абдоминальных родов. Международная федерация акушеров-гинекологов (FIGO) публикует веские эпидемиологические доказательства того, что ВП в настоящее время по существу стало ятрогенным состоянием в результате повышения частоты кесарева сечения во всем мире [11].
Врастание плаценты (placenta accreta spectrum (PAS)) - наиболее тяжелая форма из всех вариантов аномалий ее прикрепления с высоким риском маточных кровотечений, занимающих, по данным ВОЗ, лидирующие позиции среди всех причин материнской смертности [12]. При этом непосредственная доля ВП в структуре материнской смертности достигает 7% [13].
Лавинообразный рост числа аномального прикрепления плаценты, сопровождаемый вышеуказанными проблемами, способствовал созданию Международного общества под названием «International Society for Abnormally Invasive Placenta (IS-AIP)» с формированием Европейской рабочей группы по патологической инвазии плаценты (European Working Group on Abnormally Invasive Placenta (EW-AIP)), объединяющей акушеров-гинекологов, специалистов лучевой диагностики, патологов, анестезиологов, исследователей различного профиля, что, в свою очередь, позволило систематизировать ультразвуковые критерии заболевания и стандартизировать терминологию сонографических дескрипторов ВП [14].
В связи с высоким риском массивной кровопотери и материнской смертности данная патология плацентации является актуальной проблемой современного акушерства, а оптимизация диагностических алгоритмов - ее важнейшим аспектом.
Эволюция диагностики
За прошедшие десятилетия радикально изменился алгоритм постановки диагноза «врастание (приращение)» плаценты.
Во времена C. Irvinga и A.T. Herting, D.S. Forster [3, 4] патология идентифицировалась исключительно по факту осложненного течения последового (затруднения вплоть до невозможности отделения плаценты, сопровождаемые профузным маточным кровотечением) или послеродового периода (весьма обильное маточное кровотечение). «Пока нет кровотечения, истинное приращение плаценты не вызывает никаких симптомов и не распознается», - мнение академика Л.С. Персианинова в 1974 г. [15].
В настоящее время основным методом диагностики врастания плаценты является эхография [16-18]. Первый опыт ультразвуковой диагностики ВП датируется 1982 г., когда команда американских специалистов у повторнородящей филиппинки (в анамнезе одно кесарево сечение) в 25 нед гестации на фоне маточного кровотечения диагностировали предлежание плаценты с аномальной (отсутствующей) гипоэхогенной ретроплацентарной зоной. Ультразвуковой диагноз ВП был подтвержден при морфогистологическом исследовании экстирпированной из-за прогрессировавшего кровотечения матки [19].
В настоящее время дородовая диагностика ВП основывается на эхографических признаках двухмерного серошкального сканирования в комплексе с цветовым допплеровским картированием (ЦДК) и трехмерной эхографии с опцией энергетического допплера [20]. Однако при всех неоспоримых достоинствах современных ультразвуковых технологий эхография остается абсолютно операторозависимым методом, следовательно, в значительной мере субъективным, определяемым опытом специалиста в выявлении данной патологии инструментом.
Тем не менее систематический обзор и метаанализ ультразвуковых исследований (УЗИ) у 3907 беременных с риском ВП показали высокую эффективность эхографии с чувствительностью 90,7% (95% доверительный интервал (ДИ) 87,2-93,6), специфичностью 96,94% (95% ДИ 96,3-97,5) при диагностическом отношении шансов 98,59% (95% ДИ 48,8-199,0) [21].
В последующем рекомендации IS-PAS были включены в руководство FIGO по пренатальной диагностике и скринингу PAS [22, 23].
E. Jauniaux и соавт. предложили следующие термины для конкретных ультразвуковых признаков ВП и их описания [24]:
- «утеровезикальная гиперваскуляризация» (рис. 1);
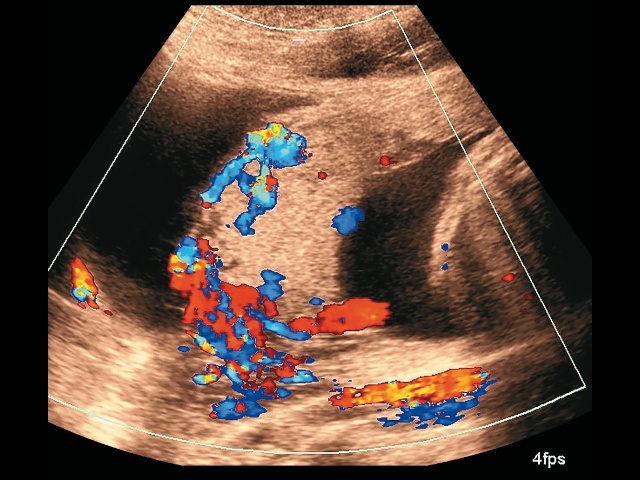
Рис. 1. Беременность 28+6 нед. PAS: утеровезикальная гиперваскуляризация. Режим ЦДК.
- «ретроплацентарная гиперваскуляризация» (рис. 2);
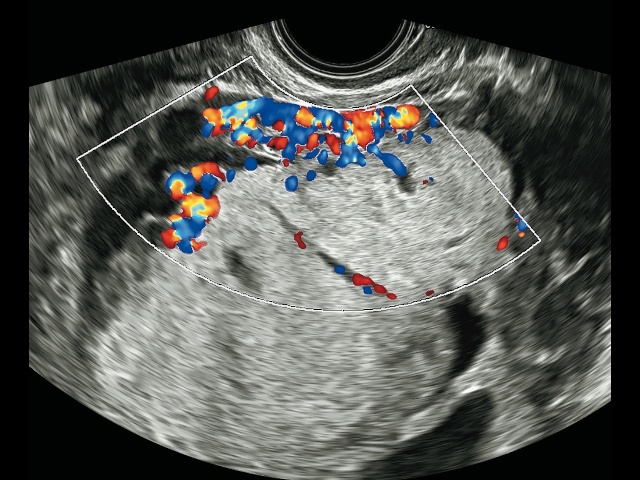
а) режим ЦДК.
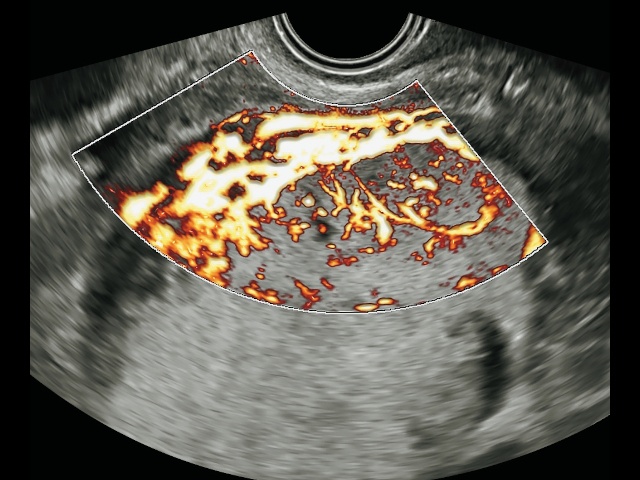
б) режим LumiFlow™ (Samsung Medison).
- «очаговая экзофитная структура в просвете мочевого пузыря» (рис. 3). В публикациях в виде кинических случаев и в когортных исследованиях о «разрыве» стенки мочевого пузыря и экзофитной массе сообщается в 33% [16];
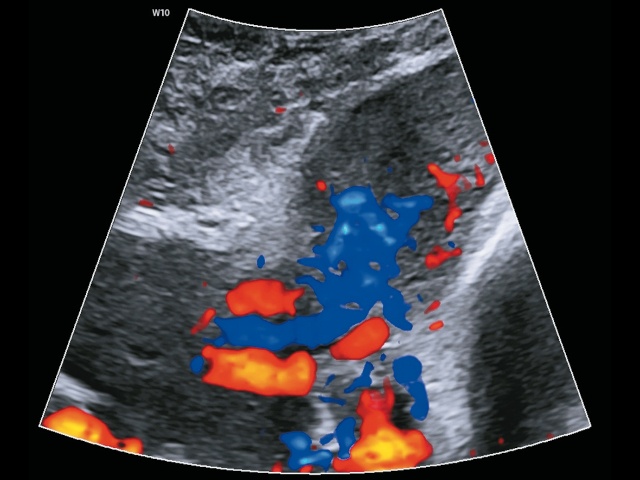
Рис. 3. Беременность 23+4 нед. PAS: очаговая экзофитная структура в просвете мочевого пузыря (режим ЦДК).
- «утрата/прерывистость стенки мочевого пузыря» (рис. 4);
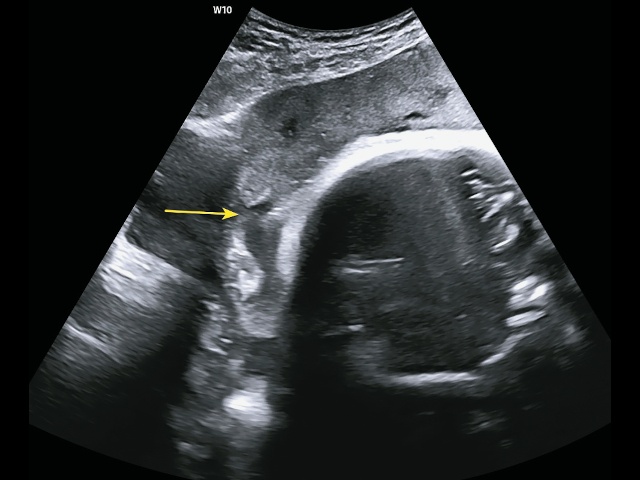
Рис. 4. Беременность 25+3 нед. PAS: утрата/прерывистость стенки мочевого пузыря (стрелка). Режим 2D-сканирования.
- «толстый» нижний сегмент плаценты (в норме толщина плаценты примерно соответствует числу недель);
- поперечный ход сосудов между маткой и стенкой мочевого пузыря - «сосудистые мостики» из миометрия, сквозь серозный покров в стенку мочевого пузыря («rail sign») (рис. 5), признак с высокой специфичностью (93,5%) [25];
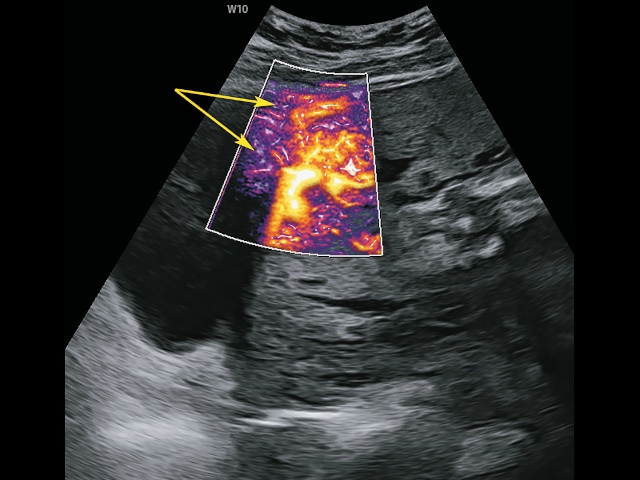
Рис. 5. Беременность 32+4 нед. PAS: сосудистые мостики (rail sign) из миометрия сквозь серозный покров в стенку мочевого пузыря (стрелки). Режим LumiFlow™ (Samsung Medison).
- прерывистость гиперэхогенной линии на границе матки и мочевого пузыря. В норме граница между миометрием и мочевым пузырем гладкая и равномерная; при приращении плаценты истончение миометрия приводит к инвазии ворсин хориона за пределы матки, в том числе в заднюю стенку мочевого пузыря, что нарушает пузырно-маточный интерфейс [26]. Наличие сосудов в этой зоне при приращении плаценты также будет вызывать ложноположительный результат наличия этого признака. Чувствительность и специфичность этого ультразвукового признака составляют 49,7 и 99,8% соответственно [21];
- наличие в толще плацентарного ложа (на материнской поверхности) более двух лакун, участков низкой эхогенности выраженно неправильной формы площадью более 1 см2, в том числе крупных (более 2 см неправильной формы) (рис. 6), содержащих турбулентный поток, видимый в серой шкале (симптом «швейцарского сыра», «плаценты, поеденной молью») (рис. 7). По классификации Finberg-Williams степень 0 означает отсутствие визуализации этих лакун при УЗИ, степень 1 - когда имеется от одной до трех лакун, степень 2 - наличие 6-8 крупных лакун, степень 3 - множество сосудистых лакун в толще всей плаценты [27]. Наличие сосудистых лакун большинством специалистов рассматривается как наиболее чувствительный сонографический признак приращения плаценты, при этом чем больше внутриплацентарных лакун, тем выше частота и степень приращения плаценты. Чувствительность и специфичность данного ультразвукового признака составляют 77,4 и 95,02% соответственно [21];
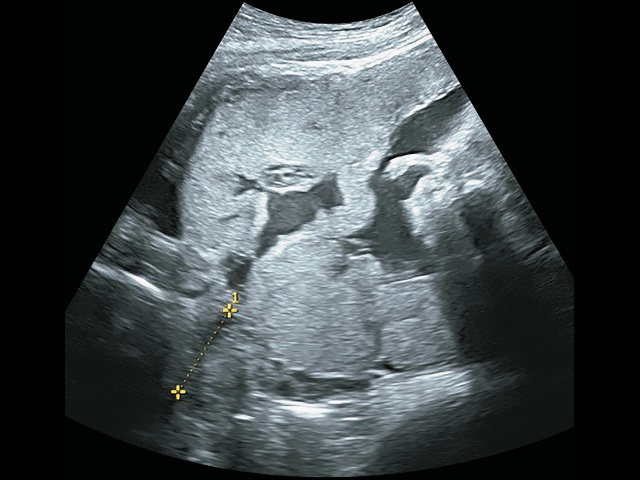
Рис. 6. Беременность 31+2 нед. PAS: плацентарные лакуны.
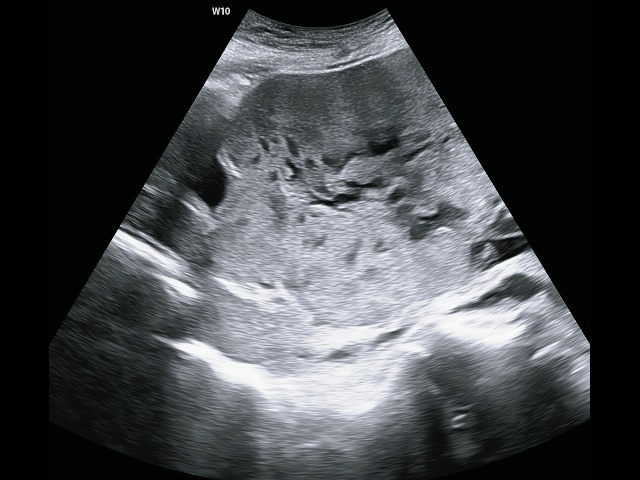
Рис. 7. Беременность 32+4 нед. PAS: симптом «швейцарского сыра».
- сосуды, питающие плацентарные лакуны, - сосуды с высокоскоростным кровотоком, отходящие от глубоких артерий в миометрии, то есть радиальные и дугообразные артерии, «подходящие» к лакунам в толще плаценты (рис. 8). В отличие от беременности без патологической инвазии плаценты, при приращении плаценты описываемые сосуды значительно крупнее и расположены далеко друг от друга;
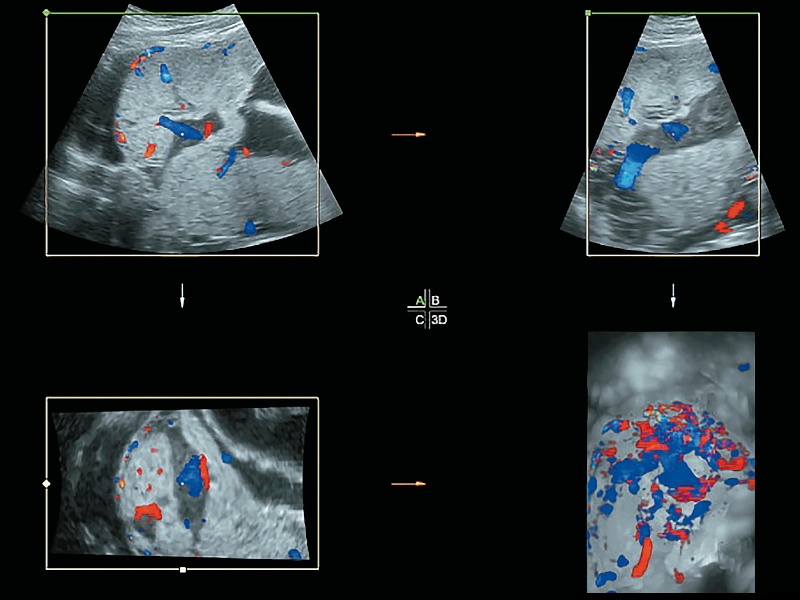
Рис. 8. Беременность 32+2 нед. PAS: сосуды, питающие плацентарные лакуны.
- выпячивание фрагментов плаценты (плацентарная грыжа) («placental bulge») (рис. 9, 10);
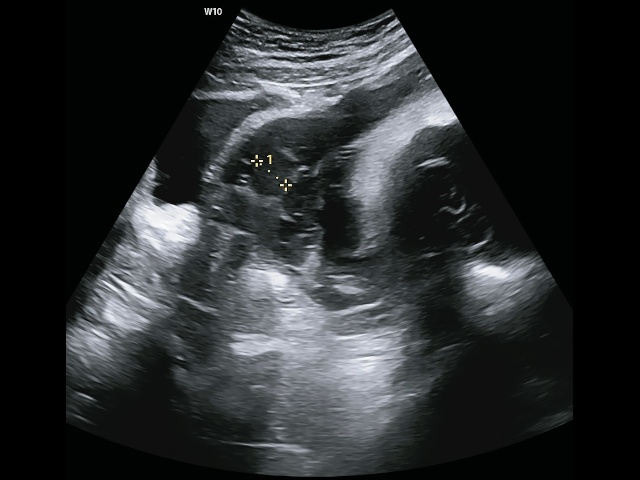
Рис. 9. Беременность 31+4 нед. PAS: выпячивание передней стенки матки в зоне плацентации (плацентарная грыжа) («placental bulge»).
а) серошкальное трансабдоминальное сканирование.
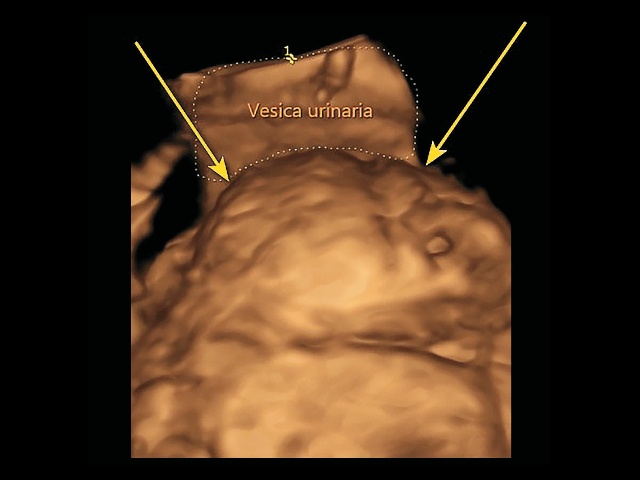
б) режим поверхностной объемной реконструкции.
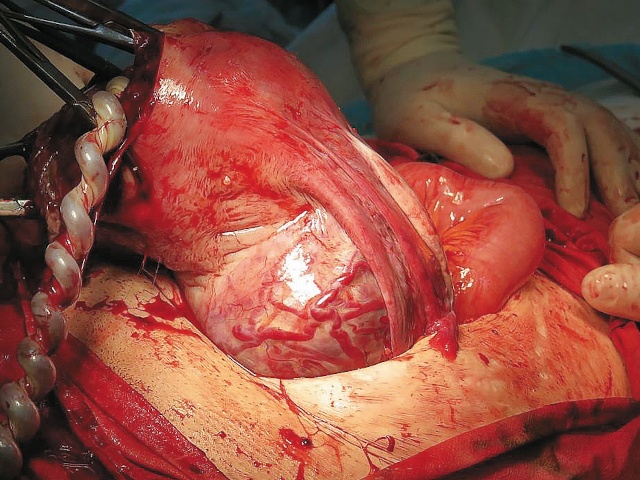
в) интраоперационный внешний вид «грыжевого выпячивания».
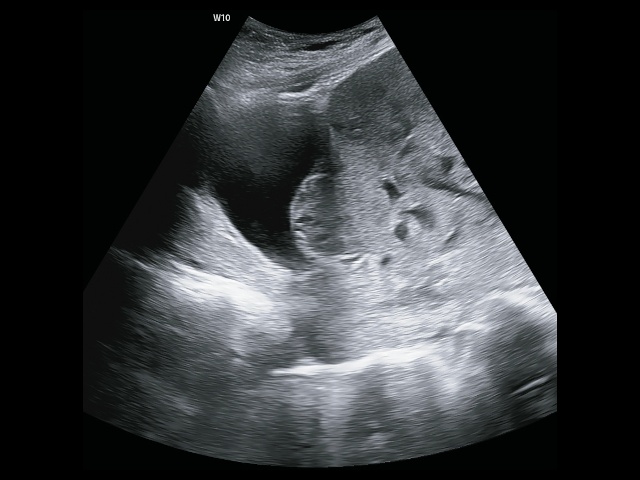
- истончение миометрия (толщина менее 1 мм или он не лоцируется (рис. 11);
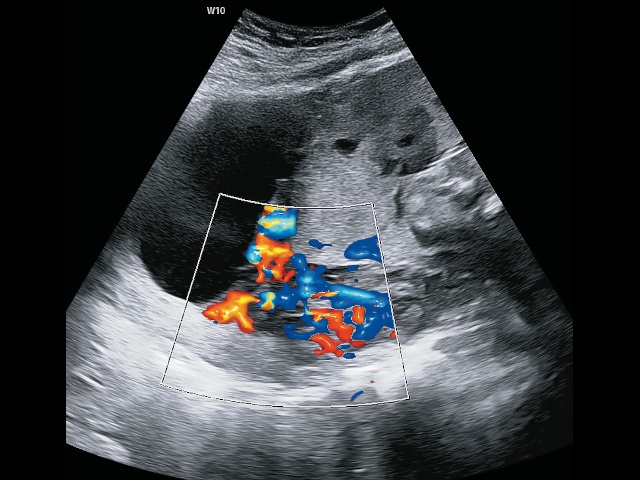
Рис. 11. Беременность 32+4 нед. PAS: ретроплацентарные лакуны, отсутствие нормальной гипоэхогенной ретроплацентарной зоны, истончение миометрия, гиперваскуляризация пузырно-маточной зоны. Режим ЦДК.
- потеря четкой гипоэхогенной зоны между плацентой и миометрием («clear zone»);
- в режиме ЦДК наличие в толще миометрия участков с лакунарным типом кровотока (рис. 11);
- васкулярные озера в миометрии с наличием турбулентного кровотока (пульсационная скорость более 15 см/с);
- визуализация кровотока в зоне «рубца» на матке;
- васкулярная инвазия в шейку матки (рис. 12);
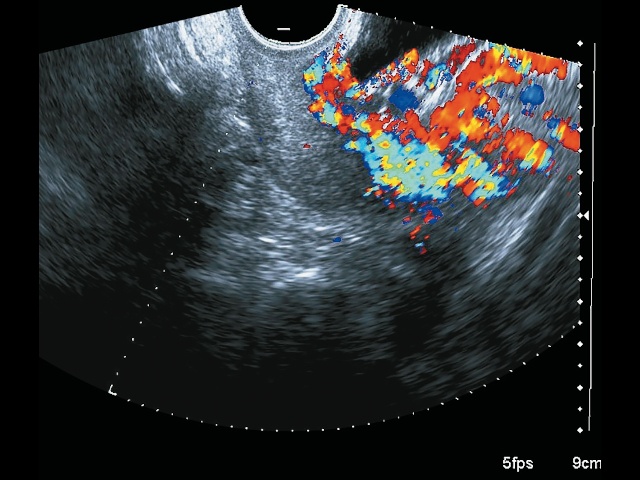
Рис. 12. Беременность 32+4 нед. PAS: васкулярная инвазия в шейку матки. Режим ЦДК.
- в режиме 3D определяется комплекс многочисленных беспорядочно расположенных разнокалиберных извилистых сосудов плаценты (рис. 13, 14).
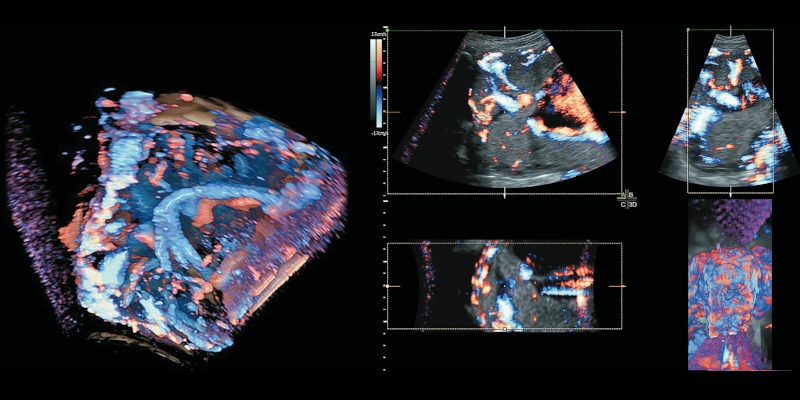
Рис. 13. Беременность 32+4 нед. PAS: комплекс многочисленных беспорядочно расположенных разнокалиберных извилистых сосудов плаценты. Режим 3D Static HD Flow™.
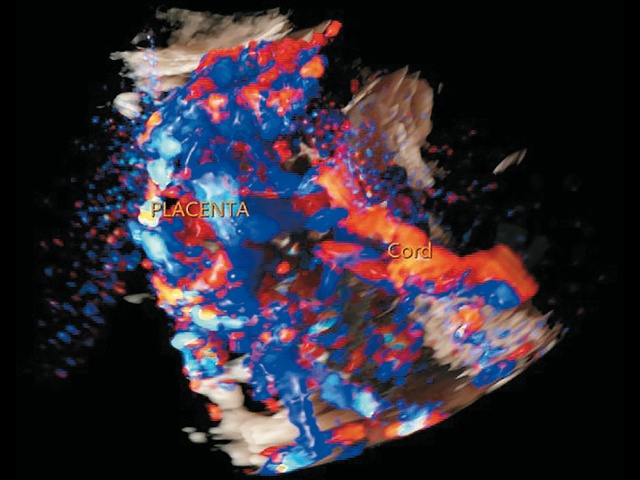
Рис. 14. Беременность 32+4 нед. PAS: комплекс многочисленных беспорядочно расположенных разнокалиберных извилистых сосудов плаценты. Режим ЦДК.
В 2015 г. для прогнозирования аномальной плацентации (ВП/PAS) в популяции женщин высокого риска разработан Placenta Accreta Index (PAI). Эту группу составили беременные с предлежанием плаценты, ранее перенесшие кесарево сечение (КС). Индекс рассчитывался с учетом количества ранее перенесенных КС в сочетании с совокупностью ряда ультразвуковых критериев (сосудистые лакуны, толщина миометрия в области нижнего маточного сегмента, локация плаценты относительно внутреннего зева, цветовые локусы), оцененных в баллах. По данным авторов методики, при общей сумме 6 баллов вероятность ВП составляла 83%, 7 баллов - 91%, 8 баллов - 96% [28].
По мере развития ультразвуковых технологий совершенствуются и развиваются диагностические возможности эхографии в обнаружении ВП/PAS. Так, в литературе имеются единичные сведения, посвященные возможности применения ультразвуковой эластографии (эхоэластографии) в диагностике ВП и предлежания плаценты. Было показано, что скорость распространения сдвиговой волны выше при предлежании плаценты. Однако в силу малого размера выборки (43 пациентки) авторам не представилось возможным определить статистически значимые различия в эластографических показателях при предлежании плаценты с наличием аномального прикрепления плаценты и без такового [29].
Наш опыт показывает, что использование технологии стереоскопической визуализации кровотока (LumiFlow™) позволяет визуализировать вовлеченность стенки мочевого пузыря беременной в конгломерат тканей аномальной плацентации (сосудистые мостики (rail sign)) из миометрия сквозь серозный покров в стенку мочевого пузыря), то есть идентифицировать placenta percreta (PAS 3b) [30].
Несмотря на разработанные классификации и ультразвуковую семиотику при различных вариантах аномального прикрепления плаценты, вопросы диагностики ВП/PAS продолжают обсуждаться. Так, по мнению E. Jauniaux и соавт. [19], до сих пор не обнаружено ни одного ультразвукового признака или комбинации признаков, специфичных для определения глубины инвазии плаценты. Для решения данной проблемы в настоящее время широкое применение нашла магнитно-резонансная томография (МРТ). Технология МРТ рассматривается в качестве полезного инструмента для оценки глубины инвазии при подозрении на placenta percreta, а также в диагностике сложных случаев, таких как преимущественное расположение предлежащей плаценты по задней стенке матки [31, 32].
Две визуализирующие технологии, УЗИ и МРТ, каждая обладающая весьма высоким диагностическим потенциалом [21, 31-35], на современном этапе развития акушерства завершили «конкурентную борьбу» за «пальму первенства» в вопросе о своей роли в обнаружении, диагностике и верификации степени PAS.
Экспертная группа FIGO по диагностике и лечению PAS постулировала [24]:
- эхография - недорогой, широкодоступный метод визуализации, поэтому должна быть первоочередной в диагностике PAS;
- МРТ не играет первоочередной роли в диагностике PAS, но может быть незаменимой для детализации топографии областей, которые сложно оценить при УЗИ.
По данным систематического обзора 2014 г. сделано заключение, что, не являясь скрининговым методом, МРТ следует рассматривать в качестве вспомогательного и при подозрении на PAS использовать после УЗИ [36].
Последнее десятилетие отмечено значительным интересом исследователей к поиску альтернативных визуализирующим технологиям (УЗИ, МРТ) методов диагностики PAS. В качестве потенциально значимых инструментов для решения данной задачи рассматривались различные сывороточные маркеры. Однако, по мнению экспертов группы FIGO по диагностике и лечению PAS [17, 24], в целом после подтверждения результатов в проспективных исследованиях данные биомаркеры могут быть использованы только в качестве дополнения к ультразвуковому скринингу, но не как самостоятельный инструмент постановки диагноза PAS.
Заключение
Как следует из вышеприведенных сведений, диагностика аномального прикрепления плаценты (врастания, приращения) на современном этапе развития акушерства в принципе не представляет значительных трудностей. Так, эхография позволяет формировать группу пациенток с высоким риском PAS, выявляя косвенные признаки аномальной плацентации уже в I триместре гестации. Y.J. Chen и соавт. сообщают об успешной «диагностике» placenta accreta в 9 нед беременности [37]. Мы располагаем собственным опытом успешной идентификации глубокой инвазии хориона, обнаруженной в сроке гестации 7+1 нед, реализовавшейся в последующим в placenta increta [38].
Известно, что и УЗИ, и МРТ обладают высоким диагностическим потенциалом в диагностике PAS [21, 28, 36]. Однако, как показали недавние зарубежные исследования, до родов PAS не диагностируется в 2/3 случаев, при том что в 1/3 случаев это происходит в специализированных многопрофильных стационарах (цит. по [20]). По данным A. Eller и соавт., в 28% случаев пренатально сформулированный диагноз PAS не имел гистопатологического подтверждения [39].
Парадокс данной ситуации объясняется следующим.
Во-первых, пренатальный диагноз PAS в определенной степени субъективен и определяется опытом специалиста в выявлении данной патологии, который может быть ограничен редкостью ее встречаемости, отсутствием тренировочных программ, классом используемого оборудования [20].
Во-вторых, в настоящее время остается актуальным, но не получившим окончательного ответа ряд вопросов. Например, следующие: Кому проводить УЗИ для выявления PAS? Достаточно ли безвыборочного скринингового исследования по аналогии с таковым как в случае формирования групп риска по хромосомным аномалиям? Или необходим селективный ультразвуковой скрининг в группе женщин, имеющих в анамнезе КС?
Когда проводить данное исследование? В сроки раннего пренатального скрининга (11-13+6 нед), регламентированного в нашей стране Приказом МЗ РФ №1130н от 20.10.2020? Или, учитывая тесную связь между PAS и вариантом эктопической беременности - рубцовой беременности (cesarean scar pregnancy), для которого требуется максимально ранняя диагностика, в сроке 7-8 нед [40], формирование когорты пациенток для селективной скрининговой эхографии проводить в эти же сроки?
Кто должен проводить исследование? Ответ, с нашей точки зрения, прост. Целенаправленный поиск PAS должен быть обеспечен подготовленным специалистом экспертного уровня, врачом акушером-гинекологом, компетентным в вопросах ультразвуковой диагностики, эксплуатирующим высокоразрешающее современное оборудование.
И, в заключение. Несмотря на бесспорный диагностический потенциал выявления PAS описанных выше визуализирующих технологий (УЗИ, МРТ), они не обеспечивают 100% верификацию патологии. Окончательный диагноз устанавливается сначала интраоперационно (рис. 15) и далее только в ходе патологоанатомического исследования (рис. 16-18), помня о том, что клинические и патологоанатомические диагностические стандарты для PAS мало изменились с 1937 г.
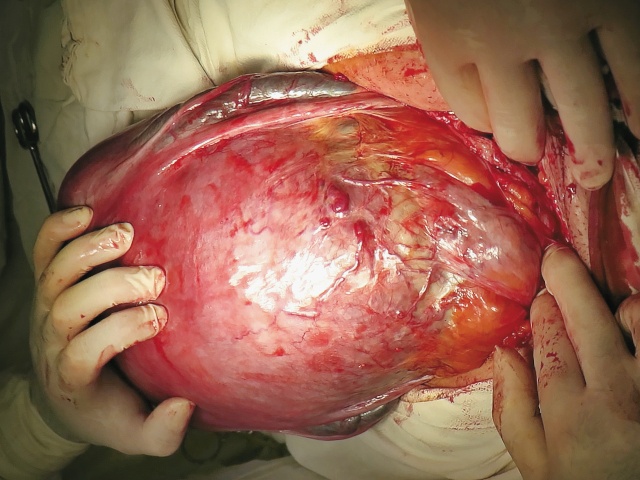
Рис. 15. Placenta percreta (PAS 3b): интраоперационный вид.
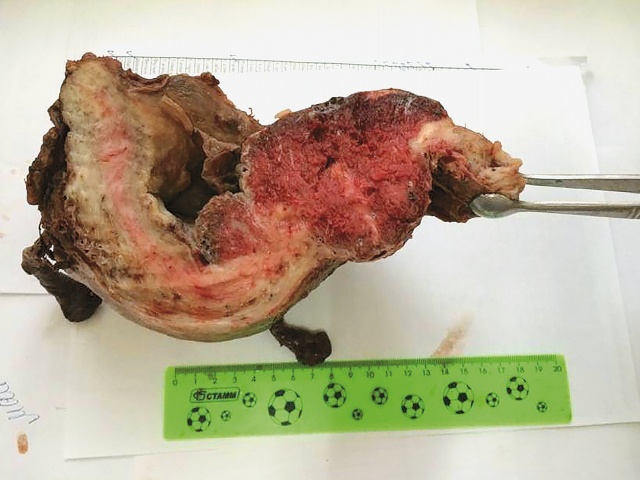
Рис. 16. Макропрепарат удаленной матки (placenta percreta (PAS 3с)): в зоне рубца прикрепление большей части плаценты и прорастание ворсин в параметральную жировую клетчатку.
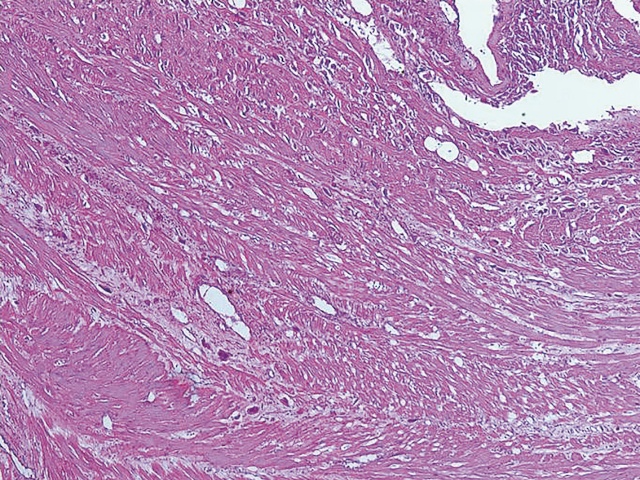
Рис. 17. PAS. Микрофотография. Глубокая инвазия клеток синцитиотрофобласта в миометрий. Окраска гематоксилин-эозином. х 50.
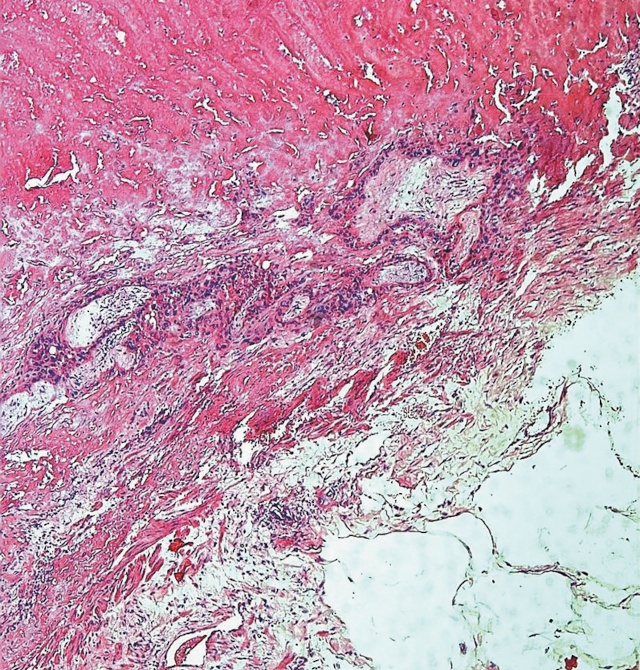
Рис. 18. PAS. Микрофотография. В зоне рубца фибриноидный некроз, инвазия клеток трофобласта и ворсин в клетчатку параметрия. Окраска гематоксилин-эозином. х 50.
Литература
- Jauniaux E., Collins S., Burton G. Placenta accreta spectrum: pathophysiology and evidence-based anatomy for prenatal ultrasound imaging // Am J Obstet Gynecol. 2018; 218 (1): 75-87. https://dx.doi.org/ 10.1016/j.ajog.2017.05.067.
- Скульский М.А. Случай двухмѣсячного задержанiя плаценты // Журналъ акушерства и женскихъ болезней. Санкт Петербургъ, 1909; Т. XXIII: 1023-1024.
- Irving C., Hertig A.T. A study of placenta accreta // Surg Gynecol Obstet. 1937; 64: 178-200.
- Forster D.S. A case of placenta accrete // Can Med Assoc. J. 1927; 17: 204-207.
- MacDonald K. How to prevent septicaemia in cases of morbidly adherent placenta // Br Med J. 1885; 1268: 779-780.
- Luke R.K., Sharpe J.W., Greene R.R. Placenta accreta: the adherent or invasive placenta // Am J Obstet Gynecol. 1966; 95 (5): 660-668. DOI: 10.1016/s0002-9378(16)34741-x.
- Малиновский М.С. Оперативное акушерство. М.: Медгиз, 1955. 108 с.
- Breen J.L., Neubecker R., Gregori C.A., Franklin J.E. Placenta accreta, increta and percreta. A survey of 40 cases // Obstet Gynecol. 1977; 49 (1): 43-47.
- Morison J.E. Placenta accreta. A clinicopathologic review of 67 cases // Obstet Gynecol Annu. 1978; 7: 107-123.
- Виницкий А.А., Шмаков Р.Г., Чупрынин В.Д. Сравнительная оценка эффективности методов хирургического гемостаза при органосохраняющем родоразрешении у пациенток с врастанием плаценты // Акушерство и гинекология. 2017; 7: 68-74.
- Palacios-Jaraquemada J.M., D`Antonio F., Buca D. et al. Systematic review on near miss cases of placenta accrete spectrum disorders: correlation with invasion topography, prenatal imaging, and surgical outcome // J Matern Fetal Neonatal Med. 2019; 30: 1-8. https://dx.doi.org/10.1080/14767058.2019.1570494
- Say L., Chou D., Gemmill A. et al. Global causes of maternal death: A WHO systematic analysis // Lancet Glob Heal. 2014; 2 (6): e323-e333. https://dx.doi.org/ 10.1016/S2214-109X(14)70227-X
- O’Brien J.M. The management of placenta percreta: conservative and operative strategies // Am J Obstet Gynecol. 1996; 175 (6): 1632-1638. https://dx.doi.org/ 10.1016/s0002-9378(96)70117-5
- Collins S.L., Alemdar B., van Beekhuizen H.J. et al. Evidence-based guidelines for the management of abnormally invasive placenta: recommendations from the International Society for Abnormally InvasivePlacenta // Am J Obstet Gynecol. 2019; 220 (6): 511-526. https://dx.doi. org/ 10.1016/j.ajog.2019.02.054
- Персианинов Л.С. Акушерский семинар. Изд. 2-е, перераб. и доп. Т.1. Ташкент: Медицина, 1974. 306 с.
- Jauniaux E., Collins S.L., Jurkovic D., Burton G.J. Accreta placentation: a systematic review of prenatal ultrasound imaging and grading of villous invasiveness // Am J Obstet Gynecol. 2016; 215 (6): 712-721. https://dx.doi.org/ 10.1016/j.ajog.2016.07.044
- Jauniaux E., Chantraine F., Silver R.M., Langhoff-Roos J. FIGO consensus guidelines on placenta accreta spectrum disorders: Epidemiology // Int J Gynecol Obstet. 2018; 140 (3): 265-273. https://dx.doi.org/10.1002/ijgo.12407
- Jauniaux E., Bhide A. Prenatal ultrasound diagnosis and outcome of placenta previa accreta after cesarean delivery: a systematic review and meta-analysis // Am J Obstet Gynecol. 2017; 217 (1): 27-36. https://dx.doi.org/ 10.1016/j.ajog.2017.02.050
- Tabsh K.M., Brinkman C.R., King W. Ultrasound diagnosis of placenta increta // J Clin Ultrasound. 1982; 10 (6): 288-290. https://dx.doi. org/ 10.1002/jcu.1870100610
- Гус А.И., Бойкова Ю.В., Ярыгина Т.А., Яроцкая Е.Л. Современные подходы к пренатальной диагностике и скринингу врастания плаценты (обзор рекомендаций) // Акушерство и гинекология. 2020; 10: 5-12. https://dx.doi.org/10.18565/aig.2020.10.5-12
- D’Antonio E., Lacovella C., Bhide A. Prenatal identification of invasive placentation using ultrasound: systematic review and meta-analysis // Ultrasound Obstet Gynecol. 2013; 42 (5): 509-517. https://obgyn.onlinelibrary.wiley.com/doi/pdf/10.1002/uog.13194
- Jauniaux E., Ayres-de-Campos D., Langhoff-Roos J. et al. FIGO Placenta Accreta Diagnosis and Management Expert Consensus Panel. FIGO classification for the clinical diagnosis of placenta accreta spectrum disorders // Int J Gynaecol Obstet. 2019; 146 (1): 20-24. DOI:10.1002/ijgo.12761
- Alfirevic Z., Tang A.W., Collins S.L. et al. Ad-hoc International AIP Expert Group. Pro forma for ultrasound reporting in suspected abnormally invasive placenta (AIP): an international consensus // Ultrasound Obstet Gynecol. 2016; 47 (3): 276-278. DOI: 10.1002/uog.15810.
- Jauniaux E., Dhide A., Kennedy A. et al. FIGO consensus guidelines on placenta accreta spectrum disorders: Prenatal diagnosis and screening // Int J Gynaecol Obstet. 2018; 140 (3): 274-280. https://dx.doi.org/10.1002/ijgo. 12408
- Khurana A. Placenta and transvaginal sonography // Donald School J Ultrasound Obstet Gynecol. 2017; 11 (2): 107-114.
- Gulati A., Anand R., Aggarwal K. Ultrasound as a Sole Modality for Prenatal Diagnosis of Placenta Accreta Spectrum: Potentialities and Pitfalls // Indian J Radiol Imaging. 2021; 31 (3): 527-538.
- Finberg H.J., Williams J.W. Placenta accreta: prospective sonographic diagnosis in patients with placenta previa and prior cesarean section // J Ultrasound Med. 1992; 11 (7): 333-343.
- Rac M.W.F., Dashe J.S., Wells C.E. et al. Ultrasound predictors of placental invasion: the Placenta Accreta Index // Am J Obstet Gynecol. 2015; 212 (343): 1-7.
- Davie S., Wong W.L., Clapham T. et al. Could Elastgraphy be used in the prediction of morbidly adherent placentation? // Case Rep Obstet Gynecol. 2016; 2016: 4909431. https://dx.doi. org/ 10.1155/2016/4909431
- Волков А.Е., Хлопонина А.В. Ультразвуковая диагностика глубокой инвазии плаценты (PAS 3b) // SonoAce Ultrasound. 2022; 34: 3-7.
- American College of Obstetricians and Gynecologists; Society for Maternal-Fetal Medicine. Obstetric care consensus. № 7. Summary: placenta accrete spectrum // Obstet Gynecol. 2018; 132 (6): 259-275. https://dx.doi. org/ 10.1097/AOG.0000000000002983
- Jauniaux E., Alfirevic Z., Bhide A.G. et al. Placenta praevia and placenta accreta: diagnosis and management. Green-top Guideline № 27a // BJOG. 2019; 126 (1): 1-48. https://dx.doi. org/ 10.1111/1471-0528.15306
- Cuthbert F., Vinas M.T., Whitby E. The MRI features of placental adhesion disorder - a pictorial review // Br J Radiol. 2016; 89 (1065): 20160284. https://dx.doi.org / 10.1259/bjr.20160284
- Palacios-Jaraquemada J.M., Bruno C.H. Placenta Accreta Spectrum: Surgical Management After Using Placental Magnetic Resonance Imaging (pMRI). In: Malvasi A. (ed). Intrapartum Ultrasonography for Labor Management. Springer, Cham. 2021.
- Мащенко И.А., Труфанов Г.Е., Ефимцев А.Ю. и др. Магнитно-резонансная томография в диагностике приращения плаценты у беременных во II и III триместрах: Учебное пособие. СПб.: ИП Маков М.Ю., 2021. 78 с.
- D’Antonio E., Lacovella C., Palacios-Jaraquemada J. et al. Prenatal identification of invasive placentation using magnetic resonance imaging: systematic review and meta-analysis // Ultrasound Obstet Gynecol. 2014; 44 (1): 8-16.
- Chen Y.J., Wang P.H., Liu W.M. et al. Placenta accreta diagnosed at 9 weeks' gestation // Ultrasound Obstet Gynecol. 2002; 19 (6): 620-622. https://dx.doi.org/10.1046/j.1469-0705.2002.00707.x
- Волков А.Е., Солонченко А.С., Рымашевский А.Н. и др. Ранняя диагностика аномально глубокой инвазии хориона - предиктора врастания плаценты // Акушерство и гинекология. 2024; 3: 180-186. https://doi.org/10.18565/aig.2024.33
- Eller A., Porter T., Soisson P., Silver R. Optimal management strategies for placenta accreta // BJOG. 2009; 116 (5): 648-654. https://doi.org/10.1111/j.1471-0528.2008.02037.x
- Эсетов М.А., Эсетов А.М. Эхография в эмбриональном периоде. Беременность в рубце на матке. М.: Издательский дом Видар-М, 2020: 95-128.

УЗИ аппарат HM70A
Экспертный класс по доступной цене. Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.
Публикации по теме
- Spina bifida: случай из пренатальной практики - Макарова Е.С.
- Возможности ранней диагностики расщелин губы и нёба - Мазырко М.А.
- Эволюция диагностики аномальной плацентации (placenta accreta spectrum) - Волков А.Е.
- Оценка диагностических критериев аномалий развития матки при трехмерном ультразвуковом исследовании - Эсетов М.А.
- Оценка ушной раковины плода как ключ к диагностике более серьезных изменений и синдромальной патологии. Два случая пренатальной диагностики - Мазырко М.А.


