Единственный артериальный ствол в раннем II триместре. Что за этим стоит?
2 Казанская государственная медицинская академия - филиал ФГБОУ ДПО РМАНПО Минздрава России, Казань
3 Патологоанатомическое отделение РКБ Минздрава Республики Татарстан, Казань
Рубрика: Эхография в акушерстве
УЗИ сканер HS60
Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Широкое внедрение комбинированного пренатального скрининга I триместра с использованием экспертного ультразвукового оборудования привело не только к ранней диагностике плодов с синдромом Дауна, но и к ранней диагностике пороков сердца у плода. На сроке беременности 12-13 нед врачи-эксперты при скрининговом исследовании обнаруживают у плодов атриовентрикулярный канал, гипоплазию левых и правых отделов сердца, единственный функционирующий желудочек, атрезию одного из атриовентрикулярных клапанов, иногда у худых пациенток врачам удается во время скрининга заподозрить транспозицию магистральных артерий, тетраду Фалло и общий артериальный ствол. При наличии множественных маркеров хромосомных аномалий у плода проводится биопсия ворсин хориона для пренатального кариотипирования. Если подозрение на порок сердца было единственным признаком неблагополучия у плода, то в абсолютном большинстве случаев беременные приглашаются на повторное УЗИ на сроке 15-18 нед.
Одной из самых сложных проблем является дифференциальная диагностика порока сердца при визуализации единственного артериального ствола, причем не только для врача ультразвуковой диагностики, но и для врача-патологоанатома. И те, и другие в большинстве случаев при обнаружении единственного артериального ствола ставят диагноз «общий артериальный ствол (ОАС)», который в принципе при исключении хромосомных аномалий имеет неплохой прогноз, в отличие от очень похожей на него картины атрезии легочной артерии (АЛА) с дефектом межжелудочковой перегородки (ДМЖП) с очень плохим прогнозом для жизни ребенка даже при удачном оперативном вмешательстве после рождения.
Остро поставленные перед нами в настоящее время задачи снижения мертворождаемости и младенческой смертности заставляют врачей пренатальной диагностики как можно раньше и как можно точнее разбираться в критических пороках развития плодов.
При анализе статистики по Республике Татарстан за последние 10 лет оказалось, что за все это время ни разу ни при УЗИ, ни на аутопсии не был поставлен диагноз «АЛА с ДМЖП», во всех случаях стоял диагноз «ОАС».
Мы решили разобраться с ситуацией и провести блиц-исследование, собственноручно тщательно проводя УЗИ всем плодам, у которых на I скрининге был выявлен единственный артериальный ствол.
Задачи блиц-исследования:
- Определить, какие пороки развития оказались при обнаружении единственного артериального ствола при скрининге I триместра.
- Определить ранние скрининговые ультразвуковые критерии дифференциальной диагностики ОАС и АЛА.
- Провести амниоцентез для проведения хромосомного микроматричного анализа (ХМА).
- Провести тщательное патологоанатомическое исследование совместно с врачом-патологоанатомом, сопоставляя данные УЗИ и аутопсии, используя ультразвуковые клипы с цветовым допплеровским картированием (ЦДК), наравне с введением красителей для идентификации сосудов.
При эхокардиографическом исследовании плода одна крупная артерия с ДМЖП и относительно нормальной четырехкамерной проекцией, за исключением незначительных аномалий, таких как аномальная ось, в большинстве случаев обусловлена либо АЛА с ДМЖП, либо ОАС.
Чтобы понять разницу между этими аномалиями, необходимо понять особенности эмбриологического развития артериального ствола и желудочков сердца. Оба желудочка сердца и артериальный ствол (белые стрелки) формируются из одного участка первичной аорты, так называемого аортального мешка (рис. 1).
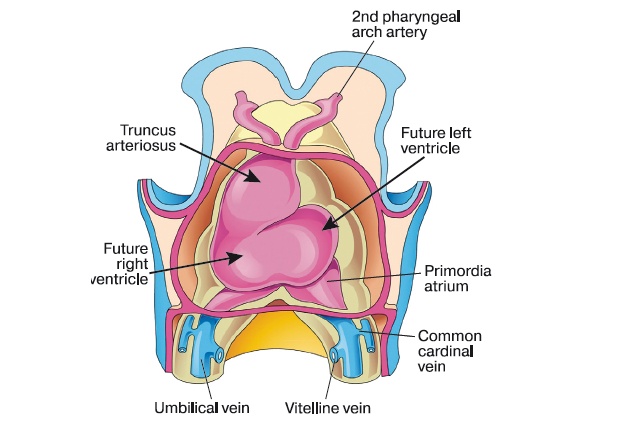
Рис. 1. Оба желудочка сердца и артериальный ствол (стрелки) формируются из одного участка первичной аорты, так называемого аортального мешка.
Процесс разделения артериального ствола начинается в корне вентральной аорты между четвертой и шестой артериями жаберной дуги. На 5-й неделе в результате активной пролиферации мезенхимных клеток в стенке сердечной луковицы формируются бульбарные гребни. В артериальном стволе образуются стволовые гребни, которые являются продолжением бульбарных гребней. По мере роста этих складок они все более выпячиваются в полость артериального ствола и, встречаясь, разделяют его на аортальный и легочный каналы (рис. 2).
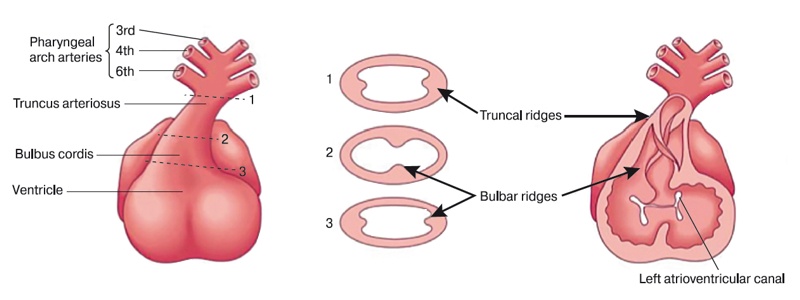
Рис. 2. Трункальные и бульбарные гребни показаны стрелками.
Спиральная ориентация гребней, вероятно, обусловливается направлением токов крови из желудочков (рис. 3).
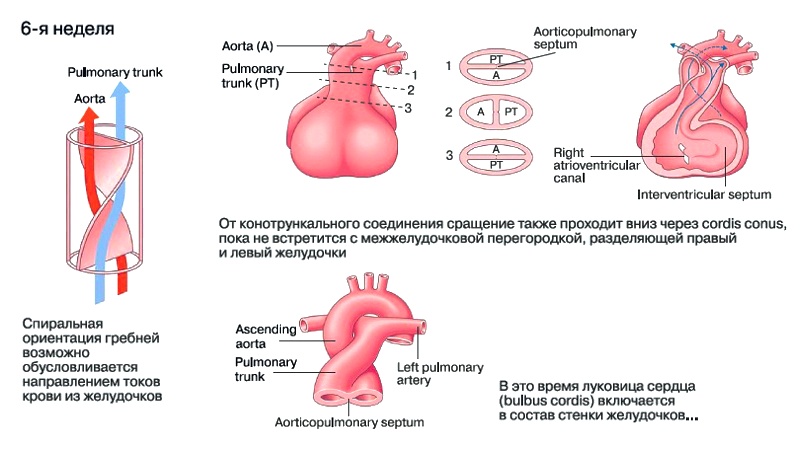
Рис. 3. Процесс разделения общего артериального ствола на аорту и легочный ствол.
От конотрункального соединения сращение также проходит вниз через cordis conus, пока не встретится с межжелудочковой перегородкой, разделяющей правый и левый желудочки.
Начиная с 7-й недели специализированные набухания тканей из конотрункального соединения развиваются в аортальный и легочный полулунные клапаны.
Образуются два подартериальных конуса: субпульмональный конус сохраняется, а субаортальной подвергается резорбции - это приводит к тому, что аорта «ныряет» в ДМЖП. Фиброзные компоненты аортального и митрального клапанов непрерывно соединены - аорта «заякорена» в левом желудочке. Таким образом, в дистальной части луковицы сердца образуются выносящие тракты правого и левого желудочков, а в артериальном стволе - аортальный клапан и клапан легочной артерии. Разделение системного и легочного кровообращения завершается к 9 нед беременности.
Аномальная миграция клеток нервного гребня через сосуды жаберной дуги во время кардиогенеза приводит к неполной септации артериального ствола и формированию ОАС.
Аномалия миграции клеток на уровне конуса заключается не только в нарушении развития аортопульмональной перегородки, но и в отсутствии всей дистальной части легочной воронки [5] с формированием врожденного порока, так называемой атрезии легочной артерии с ДМЖП, при котором отсутствует прямое сосудистое сообщение между правым желудочком и системой легочной артерии с атрезией легочного клапана и ствола.
Таким образом, оба порока - ОАС и АЛА - представлены единственным артериальным стволом, в большинстве случаев расположенным над ДМЖП (рис. 4).
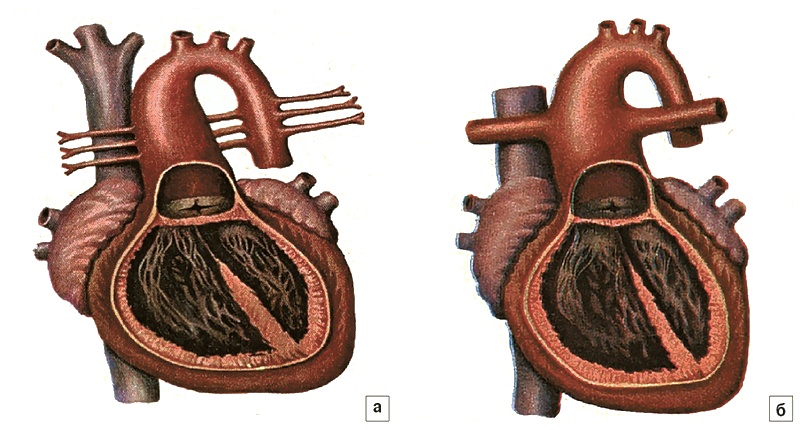
Рис. 4. а - атрезия легочной артерии с ДМЖП. Легочных артерий нет, легочный кровоток осуществляется через большие аортолегочные коллатеральные артерии (БАЛКА); б - общий артериальный ствол. Легочные артерии соединены с артериальным стволом.
Принципиальная разница между ними - это наличие или отсутствие соединений между артериальным стволом и легочными артериями. Эта разница четко просматривается в существующих классификациях АЛА и ОАС (рис. 5).
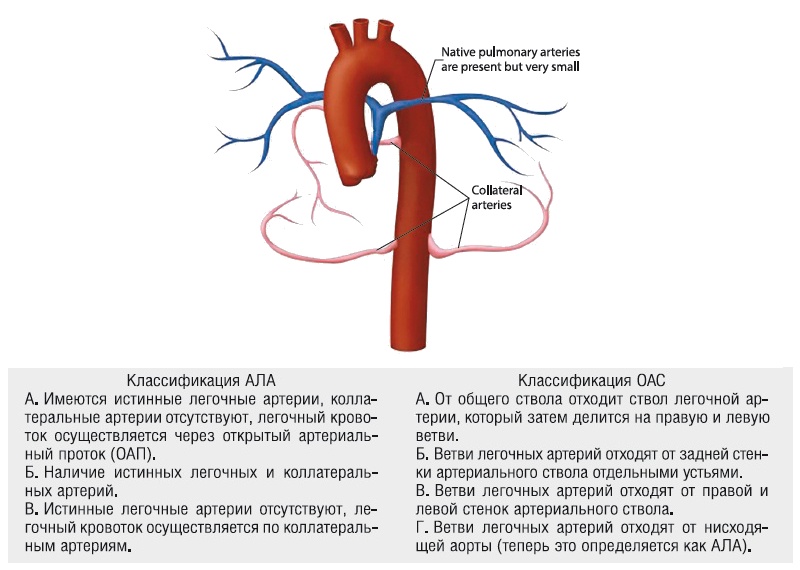
Рис. 5. Схема артерий, кровоснабжающих легкие при единственном артериальном стволе: синим цветом окрашены истинные легочные артерии, розовым цветом - боталлов проток и БАЛКА. Классификации АЛА и ОАС представлены в упрощенном виде.
Понимание того, как могут существовать истинные легочные артерии в отсутствие легочного ствола, основано на факте, что легочные артерии и боталлов проток формируются отдельно от легочного ствола из 6-й пары артерий жаберной дуги и лишь потом соединяются с формирующимся из сердечного конуса артериальным стволом (рис. 6).
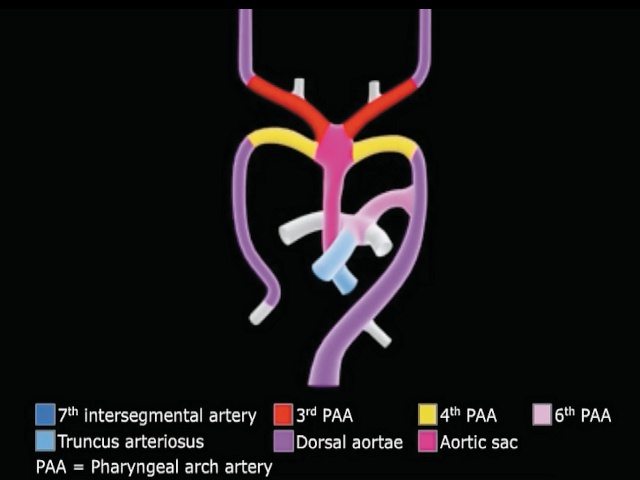
а) разными цветами окрашены артерии жаберной дуги, из разных участков которых формируются будущие сосуды.
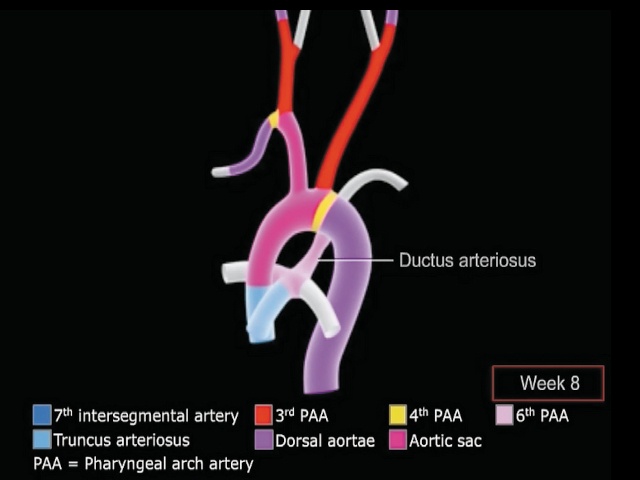
б) соответствующими цветами окрашены части уже сформированной аорты, ее ветвей, легочного ствола, легочных артерий и боталлова протока.
Легочные артерии и боталлов проток формируются из 6-й пары артерий жаберной дуги.
Дистальные части растущих легочных артерий врастают в формирующиеся легкие, проксимальные - врастают в артериальный ствол. Боталлов проток соединяется с артериальным стволом и перешейком формирующейся дуги аорты, образуя шунт для сброса избыточной крови, минуя легкие.
Любые сбои в этом процессе приводят к разнообразным порокам развития.
Результаты
Внедрение экспертного скрининга I и II триместров дает свои результаты, и в наше учреждение в течение с ноября 2022 г. по март 2023 г. было направлено на консультацию 5 беременных на сроке от 15 до 19 нед: 4 пациентки с диагнозом «общий артериальный ствол» у плода, одна из них была беременна монохориальной диамниотической двойней, и 1 беременная с диагнозом «тетрада Фалло» у плода со смещением аорты вправо и кпереди с выраженным стенозом легочной артерии.
Все беременные прошли экспертный скрининг I триместра, где у 2 беременных был заподозрен ОАС, затем на скрининге II триместра у одной был поставлен диагноз «тетрада Фалло» у плода, у 3 беременных, включая двойню, ОАС был заподозрен в ходе экспертного скрининга II триместра. При консультативном осмотре в четырех случаях единственный артериальный ствол был подтвержден, в случае с тетрадой Фалло обнаружен ОАС I типа. Всем плодам проведен ХМА с последующим тщательным ультразвуковым и патологоанатомическим исследованиями на сроке 19-20 нед. У 3 плодов была диагностирована АЛА с ДМЖП, у 1 плода - ОАС с ДМЖП, у 1 плода - двойной выход магистральных артерий с транспозицией, атрезией клапана легочной артерии и обширным ДМЖП. В 1-м и 5-м случаях были сопутствующие находки в виде коронарно-желудочковых и коронарно-предсердных фистул, кроме того, в 1-м случае была агенезия червя мозжечка, в 5-м случае - большая супратенториальная киста. У всех 3 плодов с АЛА при ХМА обнаружена микроделеция 22-й хромосомы, в 2 случаях (ОАС I типа и двойной выход магистральных артерий с АЛА) - кариотип был нормальный.
Представляем клинические случаи в том порядке, в котором они наблюдались в нашем учреждении, по описаниям и по изображениям можно увидеть, как в соответствии с поставленными задачами накапливается опыт и у врача ультразвуковой диагностики, и у врача-патологоанатома.
Клиническое наблюдение 1
Пациентка 20 лет, беременность 16-17 нед, первая.
Направлена на консультацию с диагнозом «единственный артериальный ствол», наш диагноз по данным УЗИ - «общий артериальный ствол».
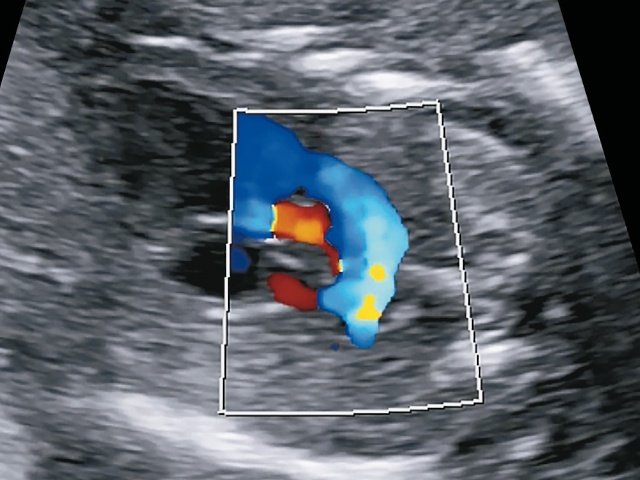
На эхограммах и препарате сердца плода видно, что ось сердца отклонена влево почти на 90° («лежачее сердце»), виден единственный артериальный сосуд, расположенный над ДМЖП бивентрикулярно (рис. 7). Обе легочные артерии увидеть не удалось. Однако видна довольно большая артерия, отходящая от ОАС вправо к легким (рис. 8в), кроме того, видна артерия, которая отходит от нисходящей части аорты и идет к легким - большая аортолегочная коллатеральная артерия (БАЛКА) (рис. 8а).
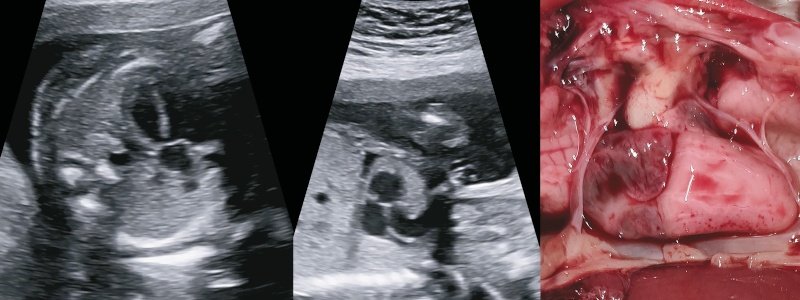
Рис. 7. На эхограммах и препарате сердца плода видно, что ось сердца отклонена влево почти на 90° («лежачее сердце»). Легочные артерии не дифференцируются, виден единственный артериальный сосуд, расположенный над ДМЖП бивентрикулярно.
Эту артерию затем удалось выделить при аутопсии (рис. 8б), ни одна истинная легочная артерия при аутопсии не обнаружена.
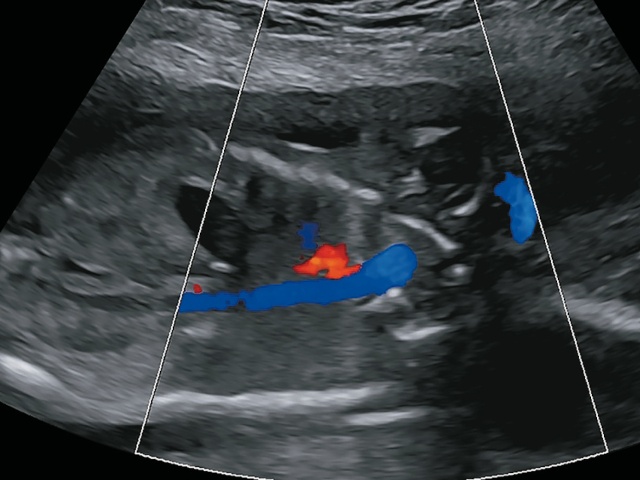
Анализируя то, что вводило нас в заблуждение, мы поняли, что из-за горизонтального расположения сердца в грудной клетке восходящая и нисходящая аорты оказались расположенными на одном уровне, и артериальный сосуд (красный цвет при ЦДК) - это не легочная артерия, а БАЛКА (рис. 8в).
а) на эхограмме видна артерия, которая отходит от нисходящей части аорты и идет к легким - БАЛКА. Известно, что коллатерали более специфичны для атрезии легочной артерии, но могут встречаться и при ОАС.
б) на макропрепарате стрелкой показана БАЛКА.
в) из-за горизонтального расположения сердца в грудной клетке восходящая и нисходящая аорты оказались расположенными на одном уровне, и артериальный сосуд (красный цвет при ЦДК) - это не легочная артерия, а большая аортолегочная коллатеральная артерия.
Патологоанатомический диагноз: атрезия легочной артерии с ДМЖП, БАЛКА.
Кариотип: микроделеция 22-й хромосомы.
Клиническое наблюдение 2
Пациентка 37 лет, беременность 17-18 нед, четвертая. В анамнезе 3 операции кесарева сечения в 2011, 2012 и 2016 гг., 3 детей - здоровы.
При УЗИ видно, что ось сердца смещена влево более 90° («лежачее сердце»), единственный артериальный сосуд, сидящий верхом над ДМЖП (рис. 9а), то же самое четко видно при аутопсии (рис. 9б).
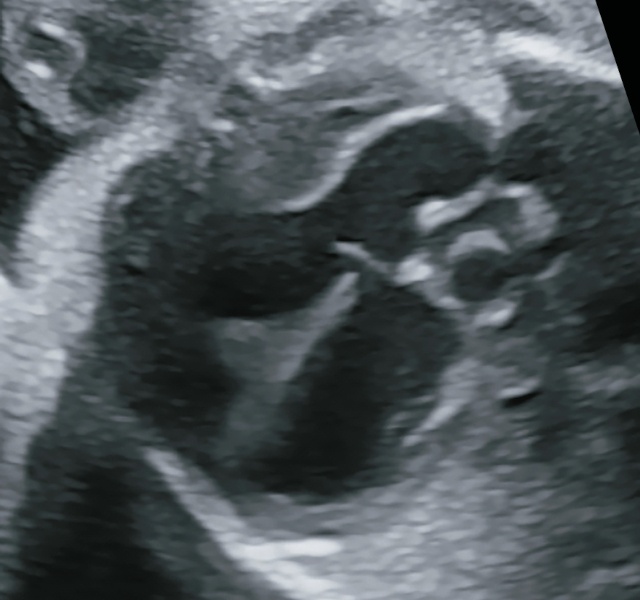
а) эхограмма.
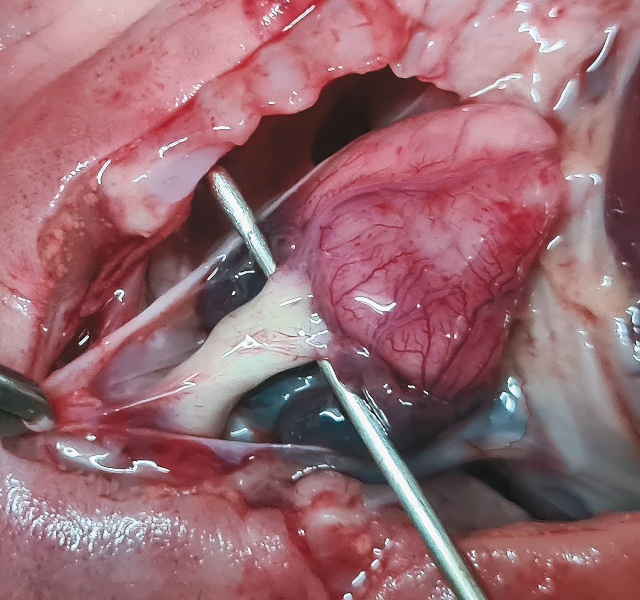
б) нативный препарат.
Аортолегочные коллатерали в виде двух параллельных дуг, идущих от нисходящей аорты, которые были хорошо видны при УЗИ с ЦДК (рис. 10а,б), увидеть достоверно при аутопсии было практически невозможно в наших условиях.
Для лучшей дифференцировки сосудов в процессе аутопсии было решено артериальный ствол и его ветви окрасить синим красителем, введенным в корень сосуда с помощью тонкой иглы, затем органокомплекс фиксировать в формалине в течение 3 дней (рис. 10в), после этого сосуды было легче выделить и убедиться, что это действительно БАЛКА.
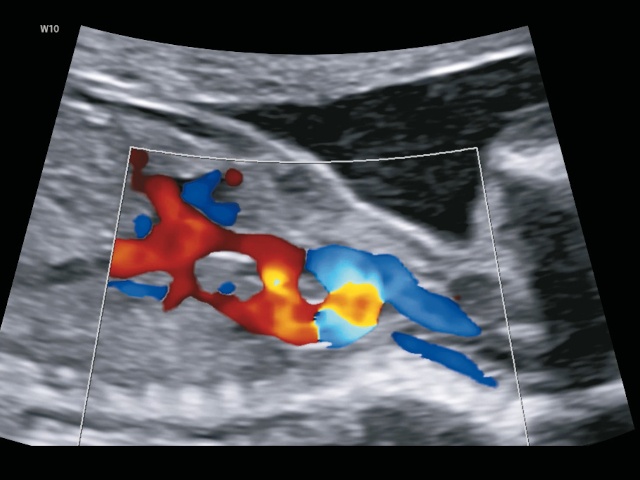
а) в режиме ЦДК.
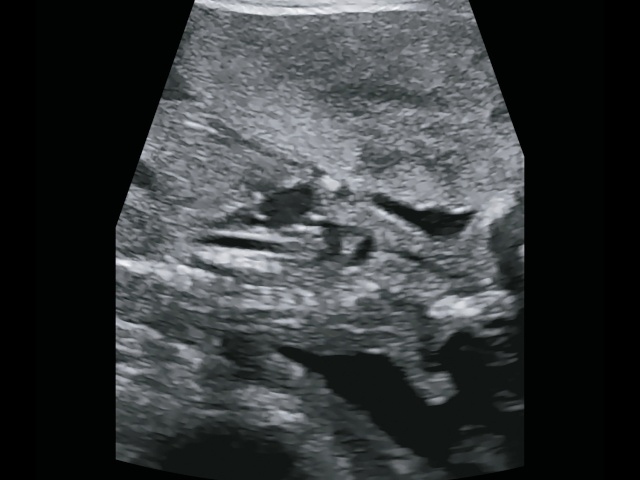
б) в В-режиме.
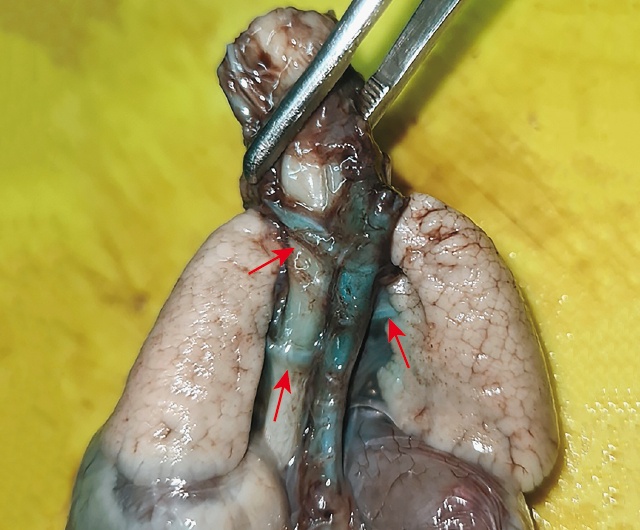
в) окрашенный макропрепарат, стрелками обозначены три БАЛКА от нисходящей аорты.
Такой подход позволил нам реально добиться подтверждения антенатального ультразвукового диагноза - АЛА с ДМЖП, постнатальный диагноз совпал с пренатальным - АЛА с ДМЖП.
Результат ХМА: микроделеция 22-й хромосомы.
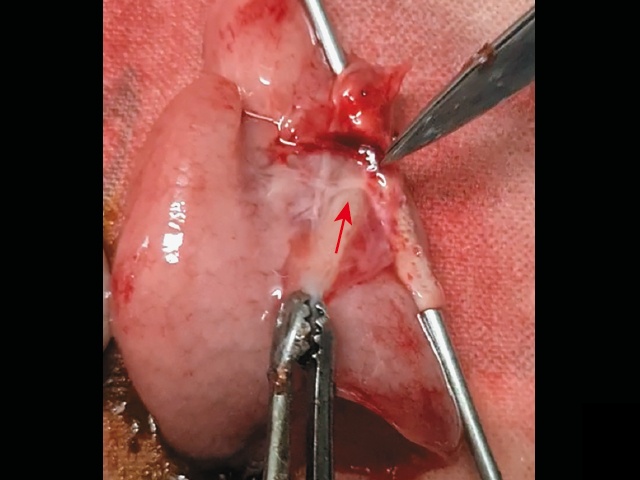
Довольно сложно идентифицировать боталлов проток - он может отсутствовать в 50% случаев как при ОАС, так и при АЛА. Помогает диагностическому процессу его расположение в типичном месте - в области перешейка. Если при нормальной анатомии он соединяется с легочной артерией, то в случае ее атрезии он идет напрямую в легкие к более мелким сосудам, таким образом, может выглядеть более длинным и иметь извилистый ход (рис. 11а). При аутопсии мы его нашли, растягивая дугу аорты, к этому моменту нечаянно рассекли его, дистальный конец его соединялся легочными ветвями (рис. 11б).
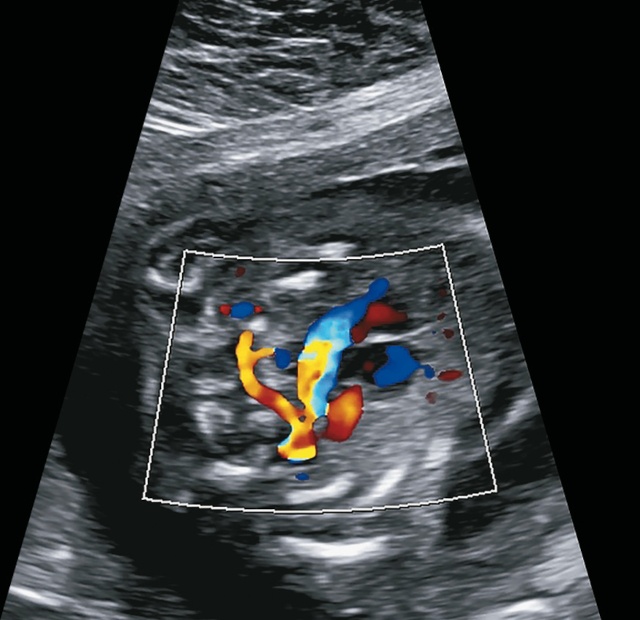
а) при ЦДК желтым окрашен извитой, аномально длинный боталлов проток.
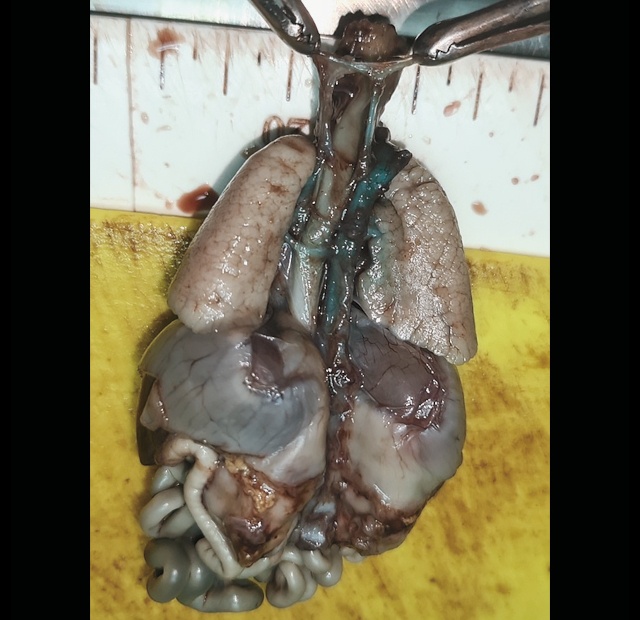
б) окрашенный препарат: от перешейка отходит длинный сосуд, который соединялся с легочными артериями - боталлов проток (отсечен, на зажиме).
Клиническое наблюдение 3
Пациентка 35 лет, беременность 18 нед, пятая.
В анамнезе кесарево сечение в 2013 и 2019 гг. - дети здоровы, 3-я беременность в 2014 г. - антенатальная гибель плода на сроке 27 нед, 4-я беременность в 2021 г. - на сроке 32 нед поставлен диагноз: двойной выход магистральных артерий из правого желудочка, ДМЖП.
Направлена с подозрением на ОАС.
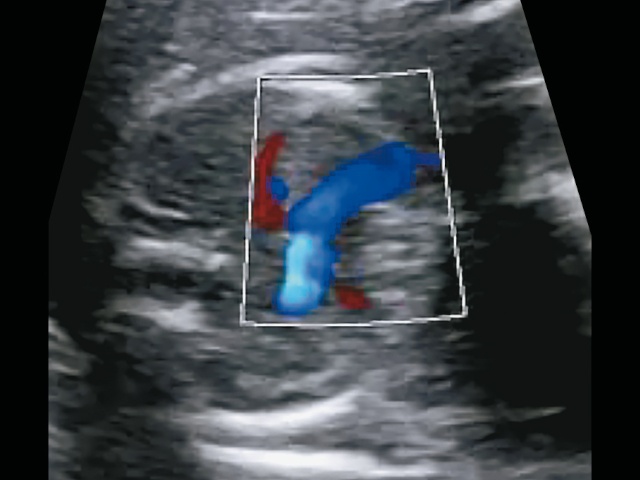
Трансвагинальное УЗИ на сроке 15 нед: порок сердца плода, более вероятно, двойной выход с транспозицией магистральных артерий из правого желудочка с гипоплазией легочного ствола. Аорта d = 2 мм, легочная артерия d = 1 мм, кровоток в ней ретроградный, ДМЖП (рис. 12), но не исключается более сложный порок - рекомендовано УЗИ через 2 нед.
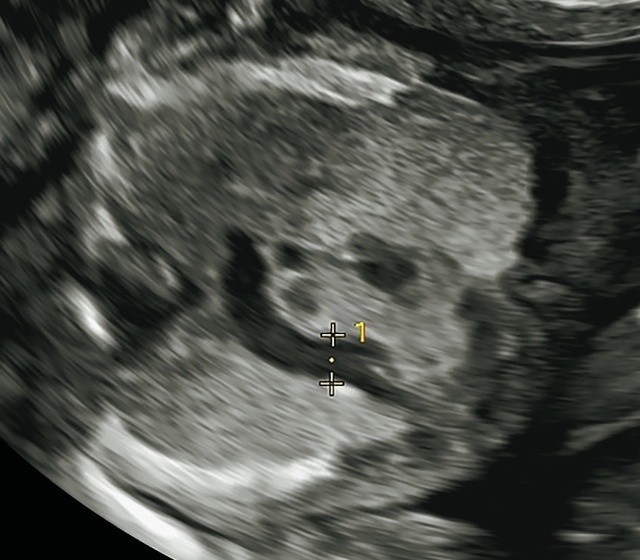
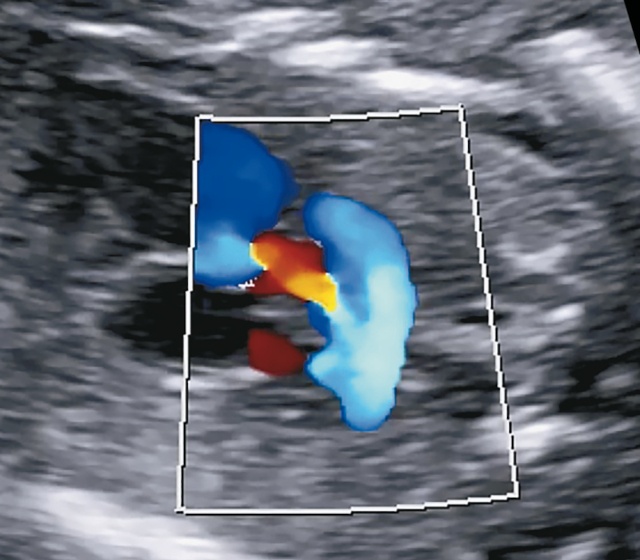
Рис. 12. Трансвагинальное УЗИ в 15 нед. Из желудочка выходят параллельно две артерии: справа - аорта, слева - легочная артерия с ретроградным кровотоком.
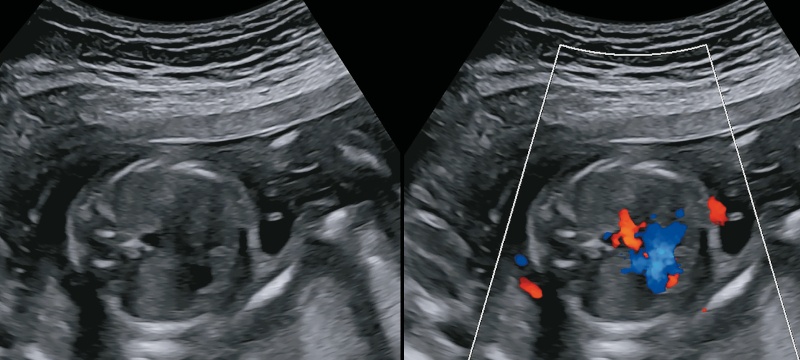
УЗИ в 18 нед: определяем эти 2 сосуда как ОАС, от которого отходит легочная артерия (ошибочно). В режиме ЦДК виден единственный ствол, а ниже желтый допплеровский сигнал - сосуды в привычных нам срезах накладываются друг на друга, предполагаем, что на аорту накладывается боталлов проток с ретроградным кровотоком (рис. 13). Результат ХМА: норма.
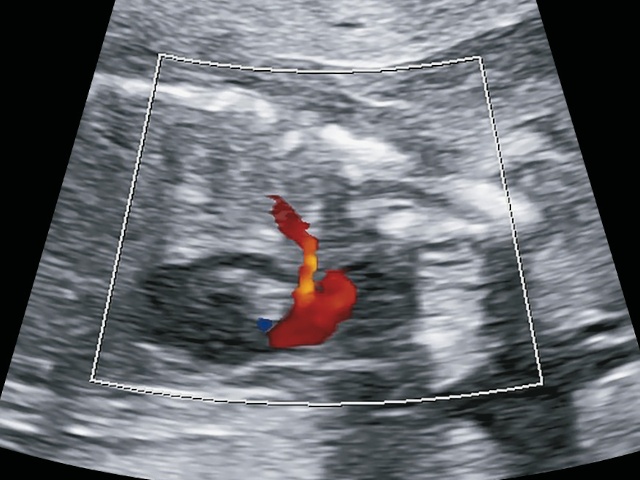
а) определяем эти 2 сосуда (см. рис. 12) как общий артериальный ствол, от которого отходит легочная артерия (ошибочно).
б) в режиме ЦДК виден единственный ствол, а ниже желтый допплеровский сигнал - сосуды в привычных нам срезах накладываются друг на друга, предположительно на аорту накладывается боталлов проток с ретроградным кровотоком.
Беременная решает прервать беременность.
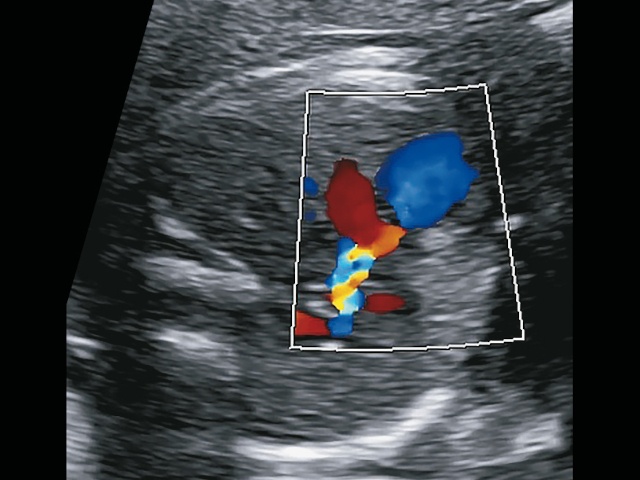
При исследовании препарата сосудов сердца плода обнаружен двойной выход магистральных артерий, боталлов проток. Клапан и ствол легочной артерии сформированы, но непроходимы (атрезированы). Возвращаемся к своим клипам УЗИ и понимаем, что красный допплеровский сигнал - это ретроградно заполняемый боталлов проток.
Боталлов проток короткий, и даже по этому признаку можно было бы сделать вывод, что, вероятно, он соединяется со стволом, который атрезирован (не прокрашивался в режиме ЦДК), а не с сосудами легких (рис. 14).
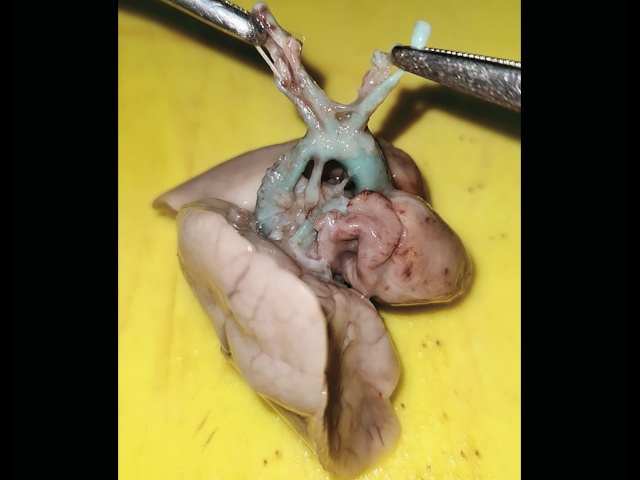
а) при исследовании препарата сосудов сердца плода обнаруживаются двойной выход магистральных артерий, боталлов проток, клапан и ствол легочной артерии, которые сформированы, но непроходимы (атрезированы).
б) красный допплеровский сигнал - это ретроградно заполняемый боталлов проток. Боталлов проток короткий, и даже по этому признаку можно было бы сделать вывод, что, вероятно, он соединяется со стволом, который атрезирован (не прокрашивается в режиме ЦДК), а не с сосудами легких.
в) при этом легочные ветви заполнялись из боталлова протока, который накладывался на аорту, казалось, что легочные артерии отходят от нее.
Клиническое наблюдение 4
Пациентка 33 года. Отягощенный акушерский анамнез. ЭКО, беременность первая, 20 нед, монохориальная диамниотическая двойня, пришла на консультацию с диагнозом «порок сердца у второго плода: тетрада Фалло, но не исключается ОАС». При консультативном УЗИ в режиме ЦДК визуализировался артериальный сосуд, идущий в правое легкое как будто бы от восходящей аорты (рис. 15а). Но, кроме того, определялась и артерия по типу БАЛКА от нисходящей аорты (рис. 15б), ось сердца смещена влево более чем на 90° («лежачее сердце»), в связи с этим был поставлени диагноз «атрезия легочной артерии с ДМЖП». У второго плода анатомия сердца в норме. У обоих плодов гипоплазия тимуса. С учетом даже минимальной вероятности ошибки в определении хориальности амниоцентез и кариотипирование амниоцитов провели у обоих плодов. У обоих плодов обнаруживается микроделеция 22-й хромосомы.
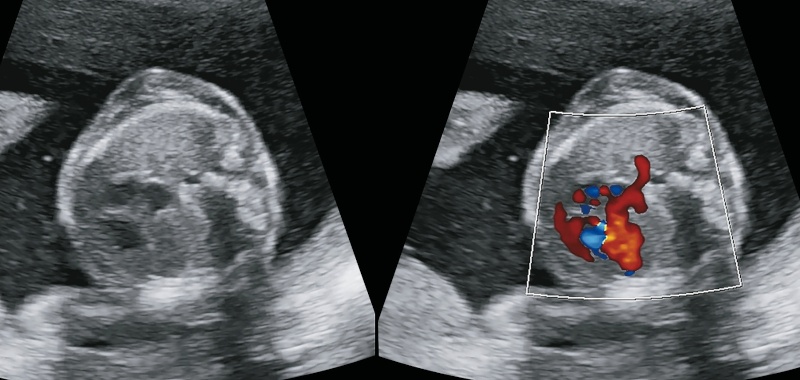
а) в режиме ЦДК как будто бы визуализируется легочная артерия, отходящая от общего артериального ствола (красный сигнал);
б) при ЦДК определяется БАЛКА от нисходящей аорты.
При патологоанатомическом исследовании подтверждается диагноз АЛА с ДМЖП у одного из плодов из монохориальной диамниотической двойни. При сравнении препаратов сердца видны изменение оси сердца («лежачее сердце») у плода с АЛА (рис. 16) и резко расширенные устья бронхиальных артерий (рис. 17).
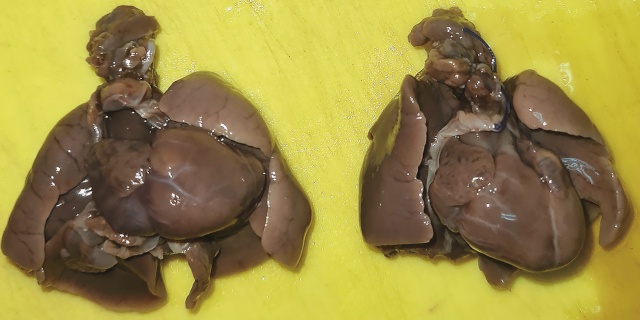
Рис. 16. Слева: органокомплекс плода с врожденным пороком сердца - единственный артериальный сосуд, ось сердца резко смещена влево.
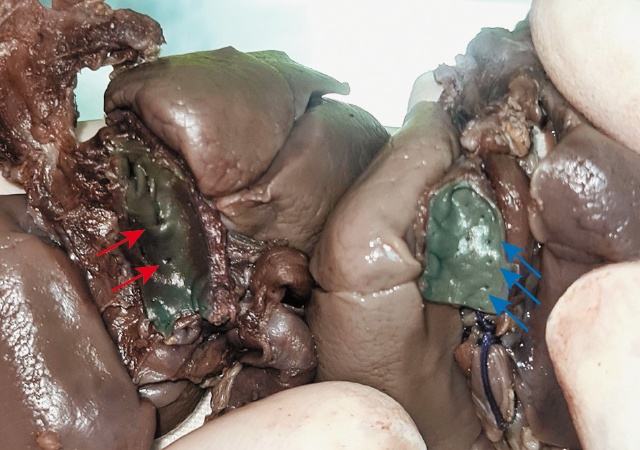
Рис. 17. На препаратах сердца обоих плодов рассечена нисходящая аорта, и достаточно интересно было увидеть отверстия больших аортолегочных коллатеральных артерий (красные стрелки) - насколько они расширены в сравнении с бронхиальными артериями у плода без порока (синие стрелки).
Клиническое наблюдение 5
Беременность 18 нед, третья, двое детей здоровы, младшему 1год. Пациентка направлена на консультацию с диагнозом «порок сердца плода: тетрада Фалло».
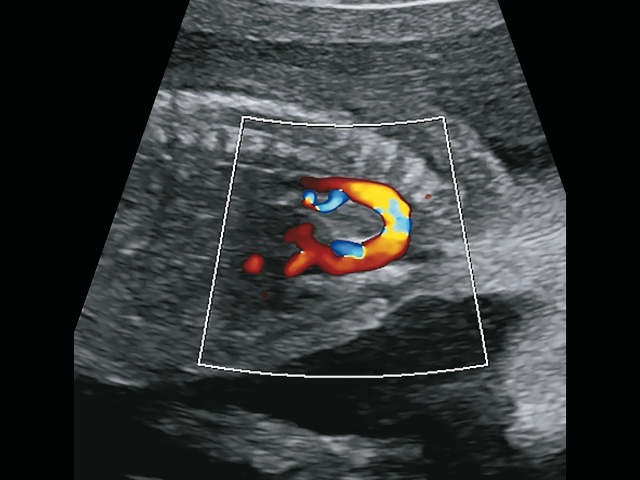
В срезе через три сосуда визуализируется типичное для тетрады Фалло расширение аорты, смещение ее вправо и кпереди, сужение легочного ствола (рис. 18).
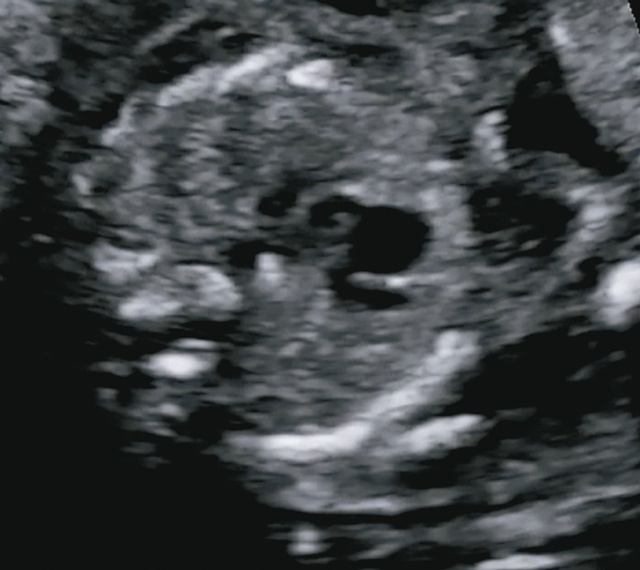
Рис. 18. В срезе через три сосуда визуализируется типичное для тетрады Фалло расширение аорты, смещение ее вправо и кпереди, сужение легочного ствола.
Однако при тщательном изучении аортального клапана видно, что клапан изменен, «мясистый», легочные артерии отходят сразу над клапаном, уровень бифуркации очень низко, близко к аортальному клапану, выходят практически из одного места с аортой, что указывает на наличие общего артериального ствола с единственным клапаном (рис. 19а,б).
Результат ХМА: норма.
Беременная принимает решение о прерывании беременности. При патологоанатомическом вскрытии диагноз ОАС подтвержден (рис. 19в,г).
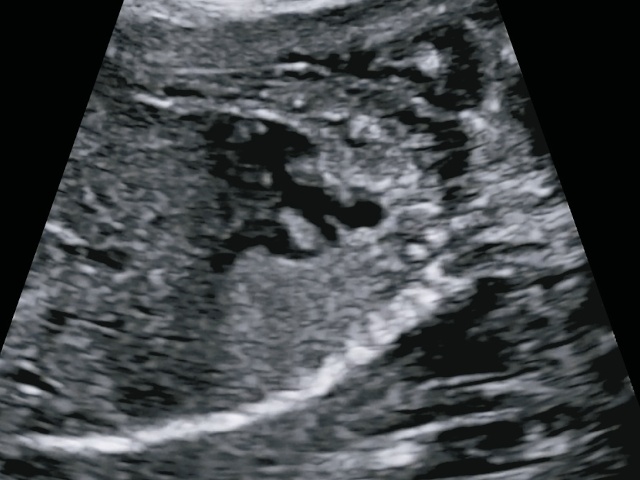
а) легочные артерии отходят сразу над клапаном, уровень бифуркации очень низко, близко к аортальному клапану, выходят практически из одного места с аортой.
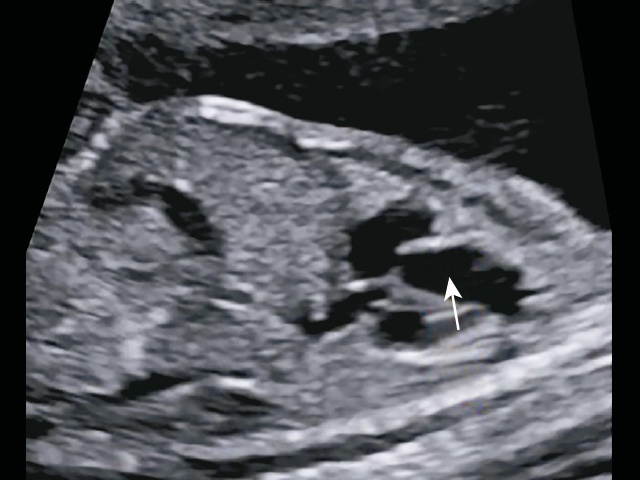
б) отхождение легочного ствола от ОАС показано стрелкой.
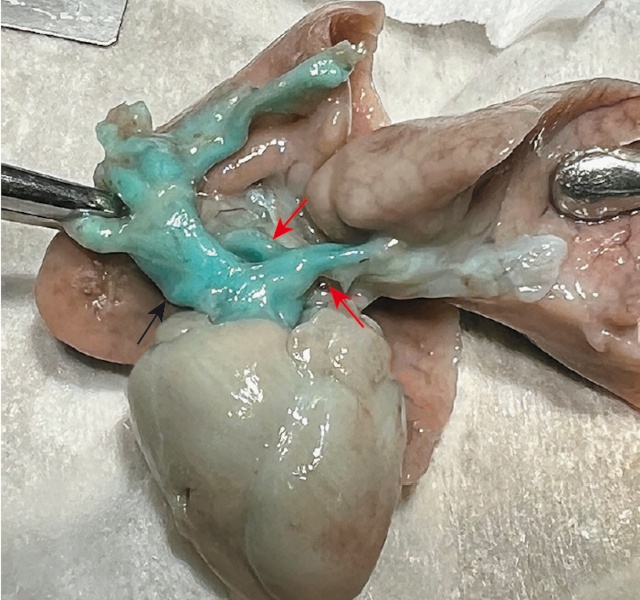
в) черной стрелкой отмечен общий артериальный ствол, красными стрелками -легочные артерии, общим стволом отходящие от артериального ствола сразу над клапаном.
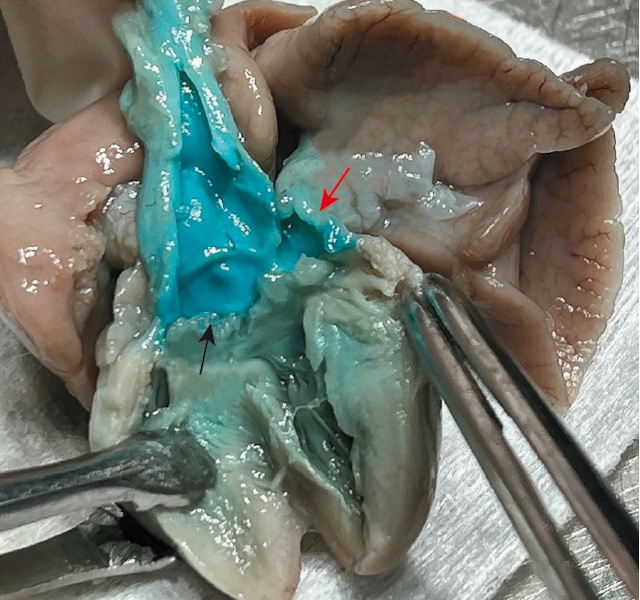
г) черной стрелкой отмечен клапан общего артериального ствола, сразу над ним расположено устье легочного ствола (красная стрелка).
Таким образом, поставить пренатально диагноз «атрезия легочной артерии с ДМЖП» довольно сложно, а когда легочная артерия есть, но атрезирована на протяжении и не прокрашивается в допплеровском режиме - едва ли представляется возможным. В этих случаях обнаружение «лежачего сердца» и БАЛКА помогает заподозрить диагноз АЛА с ДМЖП.
Кроме того, поставить этот диагноз сложно и на аутопсии. Мы на личном опыте убедились, что рассмотреть сосуды на таких сроках без предварительной окраски и фиксации препарата в формалине, и не понимая, как это выглядит при УЗИ в режиме ЦДК, также практически невозможно, и это может быть причиной неадекватной диагностики ОАС пренатально и постнатально, когда этот диагноз ошибочно подтверждается на аутопсии.
Обсуждение
Общий артериальный ствол - это редкая и сложная сердечная аномалия, составляющая 1,6% всех врожденных пороков сердца (ВПС) [1].
Порок характеризуется единственной магистральной артерией, снабжающей кровью коронарные артерии, а также системные и легочные сосуды, и часто ассоциируется с ДМЖП. Важный момент - идентифицировать легочные артерии, они отходят от восходящего отдела дуги до отхождения первой брахиоцефальной ветви аорты [2,3].
Корень ОАС в большинстве случаев имеет бивентрикулярное происхождение (перекрывает дефект перегородки). Однако почти в трети случаев корень ОАС полностью отходит от правого желудочка и, в редких случаях, полностью от левого желудочка [4].
Основные морфологические критерии общего артериального ствола как самостоятельного порока были предложены еще в 1942 г. М. Lev и О. Saphir, а первая классификация была представлена в 1949 г. W. Collet и J.E. Edwards.
Они выделили 4 типа ОАС:
- Тип 1 - от общего ствола отходит ствол легочной артеии, который затем делится на правую и левую ветви.
- Тип 2 - ветви легочных артерий отходят от задней стенки артериального ствола отдельными устьями.
- Тип 3 - ветви легочных артерий отходят от правой и левой стенок артериального ствола.
- Тип 4 - ветви легочных артерий отходят от нисходящей аорты (тип 4 теперь классифицируется как тетрада Фалло с легочной атрезией).
По классификации R. Van Praagh и S.Van Praagh (1965 г.) существует два основных типа: тип А, с ДМЖП, который является относительно частым видом, и тип Б, без ДМЖП, что бывает редко.
Оба типа также классифицируются с точки зрения магистральных артерий:
- Тип 1 - аортолегочная перегородка частично сформирована, в результате чего основная легочная артерия частично отделена - от общего артериального ствола отходит ствол легочной артерии, который делится на левую и правую ветви.
- Тип 2 - аортолегочная перегородка полностью отсутствует, следовательно, нет отдельной основной легочной артерии - ветви легочных артерий отходят непосредственно от общего ствола на одном уровне.
- Тип 3 - отсутствие одной ветви легочной артерии (любой), это легкое кровоснабжается коллатеральными сосудами - бронхиальными артериями, артериальным протоком или БАЛКА из нисходящей аорты.
- Тип 4 - определяется не характером отхождения легочных артерий, а наличием гипоплазии /коарктации, перерыва дуги аорты, наличием расширенного боталлова протока.
Типы 1 и 2 являются наиболее распространенными [6].
Европейская ассоциация кардиоторакальных хирургов допускает только 3 типа ОАС из классификации Van Praagh - аортальный доминантный, неконфлюэнтный тип и легочный доминантный (типы 1 и 2 объединены).
В некоторых случаях возможны ситуации, когда обе легочные артерии по спирали идут к легочной паренхиме. Левая легочная артерия кровоснабжает правое легкое, а правая - левое легкое - кроссинг легочных артерий (Becker A. и др., 1970).
Наиболее часто встречающимися аномалиями сердца, связанными с ОАС, являются правая дуга аорты, дефект межпредсердной перегородки, аномалии ветвей дуги аорты, коарктация аорты, дефект межпредсердно-желудочковой перегородки, митральная атрезия и аномалии расположения сердца [7].
Общий артериальный ствол часто ассоциирован с генетическими нарушениями - синдромом Ди Джорджи примерно в 40% случаев [8].
Также может встречаться при трисомии 21, 18 или 13 в 4,5% случаев или даже редкие случаи мозаицизма трисомии 8 (синдром Варкани) [9].
Дифференциальная диагностика
Проводится с другими пороками конотрункуса, сходными по ультразвуковой картине, - тетрада Фалло и атрезия легочной артерии с ДМЖП.
Отличает от других патологий клапан артериального ствола - часто деформирован, створки его изменены - могут быть «толстыми и «мясистыми» - гистологически примитивными. Количество створок может варьировать от 2 до 6, что отмечено во многих исследованиях [10].
Клапан рассматривают как аортальный, так как фиброзно он связан с митральным клапаном.
Аномальная морфология клапана часто связана с недостаточностью и регургитацией.
Наибольшие сложности возникают при дифференциальной диагностике общего артериального ствола с атрезией легочной артерии с ДМЖП. Ранее он назывался артериальным стволом IV типа (классификация Коллета и Эдвардса) или крайней формой тетрады Фалло.
Распространенность атрезии легочной артерии в 1999-2000 гг. составляла 12,1% всех ВПС и постепенно снизились до 9,6% к 2008 г. [11].
Это врожденный порок, при котором отсутствует прямое сосудистое сообщение между правым желудочком и системой легочной артерии. Он возникает из-за недоразвития вывод ного тракта правого желудочка с атрезией легочного клапана и ствола.
По классификации J. Somerville [12] выделяют 4 типа порока:
- Атрезия клапана легочной артерии. Ствол, правая и левая легочные артерии полностью сформированы и проходимы.
- Атрезия клапана и ствола легочной артерии. Обе легочные артерии сохранены и могут иметь общее или раздельное начало.
- Атрезия клапана, ствола и одной из легочных артерий. Другая легочная артерия сформирована и проходима.
- Атрезия клапана, ствола, обеих легочных артерий. Кровоток в легких осуществляется за счет сети коллатеральных сосудов.
Существует более современная классификация порока, принятая на 3-й Международной конференции по разработке номенклатуры для детской кардиохирургии в New Orleans в 1999 г.
Классификация малого круга кровообращения:
- тип А - имеются истинные легочные артерии, коллатеральные артерии отсутствуют, легочный кровоток осуществляется через ОАП;
- тип Б - наличие истинных легочных и коллатеральных артерий;
- тип В - истинные легочные артерии отсутствуют, легочный кровоток осуществляется по коллатеральным артериям.
В литературе описаны исследования, в которых приведены данные по общей диагностической точности в вопросах дифференциальной диагностики ОАС и АЛА с ДМЖП.
Сложность дифференциальной диагностики ОАС и АЛА с ДМЖП отмечают все исследователи. Так, в статье Р.М. Гасановой и соавт. в журнале «Детские болезни сердца и сосудов» (2017) сообщается [22]: «В период с 2012 по 2016 г. в перинатальном кардиологическом центре НЦССХ им. А.Н. Бакулева был проведен ретроспективный анализ 3028 плодов с ВПС. Исследуемая группа состояла из 88 плодов, у которых основной эхокардиографической находкой был один артериальный сосуд, «верхомсидящий» над ДМЖП, без явной визуализации прямой связи правого желудочка с легочной артерией . Пренатальный диагноз: 41 случай с ОАС и 47 случаев атрезии легочной артерии с ДМЖП. В 11 случаях диагноз ОАС был ошибочным, постнатально поставлены диагнозы: АЛА с ДМЖП c ОАП, АЛА с ДМЖП с ОАП и БАЛКА, комбинированный ВПС (атрезия аортального клапана с ДМЖП, гипоплазия восходящей аорты, 2 ДМПП) АЛА с интактной межжелудочковой перегородкой . В 2 случаях, ошибочно диагностированных как АЛА с ДМЖП с визуализацией ОАП, постнатально был поставлен диагноз ОАС I типа. Общая диагностическая точность пренатальной эхокардиографии в исследовании составила 84,1%».
Исследование, опубликованное в журнале «Heart» (Италия, 2003) показало: «Из 3 исследовательских центров отобраны 24 случая с пренатальным диагнозом ОАС, 23 из которых были подтверждены постнатально. В одном случае был поставлен диагноз АЛА с ДМЖП. Диагнозы были подтверждены при вскрытии или при постнатальной эхокардиографии/хирургии» [13].
По данным Amber E.L. van Nisselrooij и соавт. «Prenatal Diagnosis» (США, 2021): «Из реестра PRECOR отобрано 43 плода с пренатальным диагнозом ОАС. Согласие на вскрытие было получено для 30% (6/20) умерших плодов, пренатальный диагноз подтвержден. Постнатальная эхокардиография подтвердила диагноз у 78% (18/23) случаев живорожденных - общая точность диагностики 83% (24/29). В пяти неправильно диагностированных случаях диагноз: АЛА с ДМЖП» [14].
Чтобы поставить диагноз, нужно визуализировать ствол/культю ствола /клапан легочной артерии. Но при атрезии на большом протяжении, когда сосуд не прокрашивается в допплеровском режиме, сделать это крайне сложно.
Когда ось сердца изменена, также бывает сложным визуализировать и легочные артерии, которые отходят от ОАС ввиду их небольшого размера, наложения допплеровского сигнала. Что может помочь в этом случае? Необходимо понимание, какие источники коллатерального кровообращения легких могут быть при том или другом пороке. Наиболее значительную роль в обеспечении кровотока в легких в отсутствие истинных легочных артерий играют ОАП, БАЛКА и бронхиальные артерии [15].
Также источниками коллатерального кровообращения могут быть медиастинальные артерии, фистулы между коронарными артериями и стволом легочной артерии и смешанные формы [16].
При ОАС артериальный проток отсутствует в 50% случаев [4] - редко присутствует при типах 1 и 2, часто - при типах 3 и 4.
При АЛА артериальный проток также отсутствует в 50% случаев, может быть маленьким и извилистым, но когда он является источником легочного кровообращения, он расширяется, что облегчает диагностику. Легочная артерия и артериальный проток могут быть скрыты под дугой аорты - в этом случае помогают продольные проекции дуги аорты.
Кровоток в артериальном протоке будет ретроградным как при атрезии легочной артерии, так и при ОАС.
БАЛКА возникают из грудной или брюшной аорты, подключичных артерий, внутренних грудных артерий, межреберных артерий и т.д. БАЛКА обычно являются аберрантными и стенозированными с обоих концов.
Аортопульмональные коллатерали, отходящие от нисходящей аорты, более специфичны для легочной атрезии с ДМЖП, но они также могут встречаться и при ОАС, например, при типе 3 (Van Praagh) - контралатеральное легкое часто кровоснабжается артериальным протоком или коллатеральной артерией [17].
Частота микроделеции 22q11 высока и обнаруживается у 18-25% плодов с АЛА с ДМЖП с повышенной ассоциацией при наличии БАЛКА и/или правой дуги аорты или гипоплазии тимуса [18]. Ассоциация аортопульмонального окна с легочной атрезией и ДМЖП встречается довольно редко [19]. Этот порок также имитирует общий артериальный ствол, и требуется тщательная эхокардиографическая оценка, чтобы разобраться в анатомических тонкостях и спланировать лечение этих пациентов/прогноз. Обычно имеется ОАП, кровоснабжающий ветви легочных артерий, но когда аортопульмональное окно является единственным источником кровоснабжения легочных артерий и ствол легочной артерии атрезирован на большом протяжении, дифференциальная диагностика вызывает значительные трудности. Помощь в диагностике может дать обнаружение культи легочного ствола. В отличие от изолированной легочной атрезии, комбинация с аортопульмональным окном связана с ветвями легочных артерий хорошего размера, что облегчает хирургическое лечение [19]. Часто с атрезией легочной артерии ассоциированы следующие пороки: правосторонняя дуга аорты 20-50% всех случаев, дефект вторичной межпредсердной перегородки или открытое овальное окно наблюдается примерно в половине случаев в постнатальном периоде. БАЛКА определяются примерно в 44% случаев [18]. Одной из основных сопутствующих находок при АЛА с интактной межжелудочковой перегородкой является коронарно-желудочковая фистула, она обнаруживается примерно в 1/3 случаев [4]. Есть много публикаций, описывающих коронарно-легочные фистулы при АЛА с ДМЖП. Однако данные о сердечных коронарных фистулах при АЛА с ДМЖП крайне скудны. В нашем исследовании продемонстрировано в 2 случаях присутствие коронарно-желудочковой и коронарно-правопредсердной фистулы при АЛА с ДМЖП. Это также имеет важное значение при прогнозе: если коронарно-правожелудочковая фистула часто протекает бессимптомно и не вызывает значимых изменений в гемодинамике, то коронарно- предсердная фистула ввиду низкого давления в предсердии вызывает перегрузку объемом, что довольно быстро приводит к дилатации камер и сердечной недостаточности.
Различия с тетрадой Фалло
Аортопульмональная перегородка частично или полностью отсутствует при ОАС и АЛА с ДМЖП, но полностью сформирована при тетраде.
При тетраде Фалло происходит ротация артериального конуса против часовой стрелки - конусная перегородка не соединяется с межжелудочковой перегородкой - ДМЖП, декстрапозиция аорты, переднее смещение конусной перегородки - чем сильнее она смещена, тем выраженнее сужение легочной артерии и артериального протока. Клапан при тетраде выглядит нормально, количество створок - 3, редко - 2 створки. Толстые створки для тетрады Фалло не характерны. Определяющим для дифференциальной диагностики является обнаружение легочного ствола, отходящего от правого желудочка.
Прогноз
Оба порока имеют плохой прогноз, но все же дифференцировать эти состояния очень важно, так как атрезия легочной артерии является дуктусзависимым пороком и проходимость артериального протока имеет решающее значение для начальной выживаемости этих пациентов [20].
Структура внутрилегочных артерий в основном зависит от размера и коллатеральных сосудов. При отсутствии артериального протока или слишком большом количестве аберрантных БАЛКА внутрилегочные артерии могут не развиваться должным образом, что приводит к легочной гипертензии.
Таким образом, размер легочных артерий, наличие / отсутствие БАЛКА и артериального протока определяют план операции. Если артериальный проток является основным источником легочного кровотока, долгосрочные результаты улучшаются. Есть публикации с данными долгосрочной выживаемости при данном пороке - 61 и 75% для паллиативного и полного восстановления соответственно [21].
Наличие БАЛКА увеличивает риск сопутствующих аномалий и является значительным фактором риска поздней смертности [21,22].
Выводы
- АЛА с ДМЖП встречается почти в 10 раз чаще ОАС.
- Дифференциальная диагностика ОАС и АЛА с ДМЖП возможна в раннем II триместре при экспертном УЗИ на основании следующих мажорных признаков:
- выраженное смещение оси сердца («лежачее сердце») влево более характерно для АЛА с ДМЖП, чем для ОАС, тетрады Фалло и двойного выхода магистральных артерий из правого желудочка;
- визуализация больших аортолегочных коллатералей позволяет с большей вероятностью заподозрить АЛА с ДМЖП;
- визуализация удлиненного извитого боталлова протока может указывать на наличие АЛА с ДМЖП;
- расширенный измененный артериальный клапан с расположенными над ним двумя магистральными артериями может стать ключом к диагностике общего артериального ствола I типа.
- Вероятность хромосомных аномалий очень высокая, до 30% при ОАС и АЛА с ДМЖП, до 20 % при тетраде Фалло, поэтому необходимо проводить ХМА во всех случаях аномалий конотрункуса.
- Изучение эмбриологии сердечно-сосудистой системы всеми специалистами, включая патологоанатомов и врачей ультразвуковой диагностики, позволяет в последующем более точно проводить дифференциальную диагностику ОАС и АЛА.
Литература
- Ferencz C., Rubin J.D., Loffredo C.A., Magee C.M. The epidemiology of congenital heart disease. The Baltimore-Washington Infant Study (1981-1989). In: Perspectives in Pediatric Cardiology. New York: Futura Publishing Co. Inc, 1993.
- Cifarelli A., Ballerini L. Truncus arteriosus // Pediatr Cardiol. 2003; 24: 569-573.
- Shah S., Sukhramwala R., Maheshwari S. Aortic atresia with aortopulmonary window simulating common arterial trunk // Cardiol Young. 2009; 19 (3): 304-306. DOI: 10.1017/S1047951109003825. Epub 2009 Apr 8. PMID: 19351435.
- Abuhamad Alfred. A Practical Guide to Fetal Echocardiography: Normal and Abnormal Hearts. 3th ed. Lippincott Williams & Wilkins. 2015. 608 p.
- Abel J.S., Berg C., Geipel A. et al. Prenatal diagnosis, associated findings and postnatal outcome of fetuses with truncus arteriosus communis (TAC) // Arch Gynecol Obstet. 2021; 304: 1455-1466. https://doi.org/10.1007/s00404-021-06067-x
- Sutton D. Text book of radiology and imaging, 7th ed. Churchill Livingstone, 2003: 397-398.
- Bharati S., McAllister H.A. Jr., Rosenquist G.C. et al. The surgical anatomy of truncus arteriosus communis // J Thorac Cardiovasc Surg. 1974; 67 (4): 501-510. PMID: 4274217.
- Goldmuntz E. DiGeorge syndrome: new insights // Clin Perinatol. 2005; 32 (4): 963-978. ix-x. DOI: 10.1016/j.clp.2005.09.006. PMID: 16325672.
- Sherer D.M., Dalloul M., Pinard V., Sheu J., Abulafia O. Fetal trisomy 8 mosaicism associated with truncus arteriosus Type I // Ultrasound Obstet Gynecol. 2017; 50 (4): 541-542. DOI: 10.1002/uog.17411. Epub 2017 Sep 5. PMID: 28093816.
- Gotsch F., Romero R., Espinoza J. et al. Prenatal diagnosis of truncusarteriosus using multiplanar display in 4D ultrasonography // J Matern Fetal Neonatal Med. 2010; 23: 297-307.
- Egbe A., Uppu S., Lee S. et al. Changing prevalence of severe congenital heart disease: a population-based study // Pediatr Cardiol. 2014; 35 (7): 1232-1238.
- Somerville J. Management of pulmonary atresia // Br Heart J. 1970; 32: 641-651.
- Volpe P., Paladini D., Marasini M. et al. Common arterial trunk in the fetus: characteristics, associations, and outcome in a multicentre series of 23 cases // Heart. 2003; 89 (12): 1437-1441. DOI: 10.1136/heart.89.12.1437. PMID: 14617557; PMCID: PMC1767971.
- van Nisselrooij A.E.L., Herling L., Clur S.A. et al. The prognosis of common arterial trunk from a fetal perspective: A prenatal cohort study and systematic literature review // Prenat Diagn. 2021; 41 (6): 754-765. DOI: 10.1002/pd.5907. Epub 2021 Feb 26. PMID: 33480066; PMCID: PMC8248090.
- Kirklin J.W., Bargeron L.M.J., Pacifico A.D. et al. Management of the tetralogy of Fallot with large aortopulmonary collateral arteries. In: Godman M.J. (ed.). Pediatric cardiology. Edinburg: Churchill Livingstone, 1981; 4: 483-491.
- Алекян Б.Г., Пурсанов М.Г., Верин В.В. Атрезия легочной артерии с дефектом межжелудочковой перегородки // Тихоокеанский медицинский журнал. 2003; 1: 26-29.
- Fujiwara K., Yoshizawa K., Kato O., Sakazaki H. Truncus Arteriosus With Major Aortopulmonary Collateral Arteries // Ann Thorac Surg. 2019; 108 (2): e105-e106. DOI: 10.1016/j.athoracsur.2018.12.051. Epub 2019 Jan 30. PMID: 30710524.
- Vesel S., Rollings S., Jones A. et al. Prenatally diagnosed pulmonary atresia with ventricular septal defect: echocardiography, genetics, associated anomalies and outcome // Heart. 2006; 92: 1501-1505.
- Sejal Shah, Kavya, Rahul Saraf, Shekhar Rao. Unusual Differential Diagnosis of Common Arterial Trunk // Pediatric Cardiology. 2011; 33 (7): 1180-1182. DOI:10.1007/s00246-012-0240-9
- Sana M.K., Ahmed Z. Pulmonary Atresia With Ventricular Septal Defect. [Updated 2022 Sep 19]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan.
- Cho J.M., Puga F.J., Danielson G.K. et al. Early and long-term results of the surgical treatment of tetralogy of Fallot with pulmonary atresia, with or without major aortopulmonary collateral arteries // J Thorac Cardiovasc Surg. 2002; 124: 70-81.
- Гасанова Р.М., Беспалова Е.Д., Бокерия Е.Л., Сыпченко Е.В., Тюменева А.И., Бартагова М.Н., Александрова С.А. Насколько точно можно дифференцировать атрезию легочной артерии с дефектом межжелудочковой перегородки и общий артериальный ствол на пренатальном этапе. Результаты пятилетнего исследования // Детские болезни сердца и сосудов. 2017; 14 (4): 229-240. DOI: 10.24022/1810-0686-2017-14-4-229-240

УЗИ сканер HS60
Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Публикации по теме
- Ультразвуковая диагностика интрамуральной беременности: обзор литературы и клинические наблюдения - Эсетов М.А.
- Ультразвук в акушерском стационаре - Шумаков Ю.А.
- Единственный артериальный ствол в раннем II триместре. Что за этим стоит - Терегулова Л.Е.
- Spina bifida: случай из пренатальной практики - Макарова Е.С.
- Возможности ранней диагностики расщелин губы и нёба - Мазырко М.А.



